Биофармация является теоретической основой технологии лекарств. Сам термин «биофармацня» появился впервые в научной формации США в начале 60-годов текущего столетия и вскоре получил международное признание. Этим коротким словом удачно и достаточно полно определен комплекс зависимостей, связывающий между собой лекарственное средство и лечебный (профилактический) эффект приготовленного лекарства.
Необходимый лечебный эффект достигается сложным путем, который должно пройти любое лекарственное вещество в организме. Упрощенно схему этого пути можно представить в следующем виде.

|
Факторы, влияющие на
скорость и полноту
абсорбции
 I. Лекарство (препарат в лекарственной форме) ^_ в месте введения (применения)
I. Лекарство (препарат в лекарственной форме) ^_ в месте введения (применения)
Фармацевтические
 II. Лекарственное вещество в биожидкости на ч_ месте абсорбции
II. Лекарственное вещество в биожидкости на ч_ месте абсорбции
Фармацевтические и физиологические
III. Лекарственное вещество (или метаболиты) в крови (или в тканях)
Физиологические и биохимические
IV. Элиминация продуктов биотрансформации ле
карственного вещества (почки, желудочно-ки- ■*-
шечпый тракт, легкие, потовые железы)___________
Биохимические
Первой стадией является путь введения лекарства — пероральный, ректальный, нанесение на кожу или слизистую оболочку, инъекционный и т. д. На этой стадии лекарственное вещество должно высвободиться из формы, в которую оно облечено (таблетки, суппозитории, мази, инъекции и др.) и продиффундировать (пройти путь) до назначенного места абсорбции (всасывания).
На второй стадии лекарственное вещество, перешедшее в биологическую жидкость, всасывается, подчиняясь законам диффузии. На кинетику диффузии оказывают влияние как фармацевтические, так и физиологические растворы. К числу первых нужно отнести влияние сопровождающих веществ, например поверхностно-активных, повышающих кинетику диффузии, а также.'влияние технологических факторов, например механической прочности таблеток на скорость растворения веществ, в них находящихся. Кинетика диффузии одновременно зависит от свойств и состояния клеточных мембран, ферментной активности клетки, ее гидратированности и др.
Важное значение для всасывания имеют несомненно такие физиологические факторы, как возраст, пол и состояние организма. Физиологическим факторам принадлежит основная роль на третьем этапе всасывания, когда лекарственное вещество или его метаболиты распределяются в организме — в кровяном русле или тканях.
На заключительном этапе движения лекарственного вещества в организме доминирующими являются биохимические факторы, обусловливающие биотрансформацию лекарственных веществ и их метаболитов и элиминацию ('выведение) конечных веществ нз организма через почки, желудочно-кишечный тракт, легкие, потовые железы.
Анализируя схему, нетрудно представить, что количественная сторона процесса абсорбции лекарственных веществ лимитируется прежде всего эффективностью (кинетикой) их высвобождения на начальной стадии абсорбции. Эффективность высвобождения лекарственных веществ находится в прямой зависимости от фармацевтических факторов п их последовательного использования для продвижения действующего вещества по схеме: 1) выбор химического состояния; 2) выбор физического состояния; 3) влияние вспомогательных веществ; 4) влияние одновременно принятых медикаментов; 5) выбор лекарственной формы; 6) выбор пути введения; 7) установление точной дозировки; 8) влияние фармакотехнологических факторов; 9) определение роли физиологических факторов, свойственных отдельным лицам.
Изучение влияния указанного комплекса факторов, способствующих транспорту лекарственных веществ в организме и проявлению их лечебной активности, является основным содержанием биофармации. Однако изучение фармацевтических факторов неразрывно связано с воздействием на продвижение лекарственных веществ в организме (начиная частично уже со второй стадии абсорбции) физиологических и биохимических факторов, которые изучаются другой близкой областью научных знаний — фармакокинетикой. Таким образом, полное представление о взаимосвязях между лекарственным веществом — лекарством и лечебным эффектом дает биофармация в сочетании с фармакокинетикой. Значение элементов фармакокинетики поможет технологу в оптимальном варианте применить знание биофармации для создания эффективного лекарства.
Исследования последних трех десятилетий, проведенные отечественными и зарубежными учеными с привлечением современных физико-химических, фармакологических и биохимических методов, позволили достаточно глубоко и достоверно разобраться в тех сложных взаимоотношениях, которые сложились между лекарством как особой физико-химической системой, и макроорганизмом как биологической системой тех факторов, которые обусловливают эти взаимоотношения.
Биофармацевтическим вопросам в нашей стране уделяется большое внимание. В каждом научно-исследовательском институте, где изыскиваются новые лекарственные средства, имеются специальные лаборатории технологии лекарственных форм, в задачу которых входит разработка для нового лекарственного препарата рациональной формы
его применения. Применение ни одного нового препарата не разрешается, если для него не предложена разумная лекарственная форма, если не решены вопросы по композиции основообразующих и других вспомогательных веществ, если не найдены наиболее совершенные методы производства лекарства.
В СССР создан Всесоюзный биофармацевтический центр (во ВНИИФ), в задачу которого входят координирование научных исследований по биофармации, апробация результатов исследований и методик, рекомендации по внедрению их в практику здравоохранения.
Значение физико-химических свойств и физического состояния лекарственных веществ
Первопричиной лечебной или профилактической активности любого лекарственного вещества является его химическое строение. Однако на лечебную активность лекарственного вещества оказывают существенное влияние и его вторичные свойства, вызванные направленным технологическим вмешательством при приготовлении из него лекарства (изменение степени дисперсности, форма частичек, растворимость и др.).
Полиморфизм. Первичные свойства самой лекарственной субстанции далеко не всегда одинаковы и постоянны. Это относится прежде всего к органическим веществам, которые могут существовать в двух и более кристаллических модификациях. Такое явление, называемое полиморфизмом лекарственных препаратов, особенно распространено среди салицилатов, барбитуратов, сульфамидов, гормональных препаратов. Например, ацетилсалициловая кислота встречается в шести кристаллических формах, кортизон-ацетат—в пяти и т. д. Получение той или иной кристаллической модификации обусловливается комплексом условий, при которых протекает синтез (или выделение из природного сырья), и в большей степени — от условий, в которых протекает кристаллизация субстанции (температурный фактор, природа растворителя, давление и т. д.).
Полиморфные модификации одного и того же препарата обладают различной растворимостью, температурой плавления, стойкостью к окислению и другим деструктивным процессам и т. д., а следовательно, неодинаковыми поверхностными свойствами, от которых зависит как скорость абсорбции лекарственных веществ, так и их стабильность в лекарственных формах.
Менее стабильные кристаллические модификации обычно более растворимы в биологических жидкостях и, следовательно, лучше всасываются. Например, одна из модификаций (метастабильная) растворяется в концентрации 1200 мг/л, а другая (стабильная) —только 60 мг/л.
Полиморфные превращения лекарственных веществ возможны не только лри их получении (выделении) очистке и сушке, но и при приготовлении лекарственных форм, а также в процессе хранения последних. В последнем случае полиморфные превращения зависят от условий и сроков хранения, а также от вида применяемых при изготовлении лекарственных форм вспомогательных веществ.
Химическое состояние. Одно и то же вещество может быть использовано в качестве лекарственного средства в разных химических состояниях. В простейших случаях это может касаться солеобразования того или иного активного вещества. Например, алкалоид хинин из основания может быть переведен в разные соли: сульфат, хлорид, бромид. Его растворимость будет равна соответственно 1: 800, 1:34,
1: 16. При сохранении основной функции хинина эти его соли как обладающие разной растворимостью будут иметь разную кинетику вса-сывания.
Еще более разителен следующий пример. При замене иона водорода в аскорбиновой кислоте на ион натрия препарат при сохранении основной функции витамина С приобретает новые, не характерные для аскорбиновой кислоты свойства — способность изменять электролитный баланс организма в большей степени, чем аскорбиновая кислота, угнетать функцию инсулярного аппарата у больных сахарным диабетом.
Продолжая примеры, можно напомнить, что производство буровской жидкости основывается на получении только однозамещенного ацетата алюминия, а не каких-либо других солей, поскольку антисептическое действие свойственно только этому соединению.
При переходе через липоидный барьер (стенка желудка, кишечника) большую роль играет степень ионизации. Препараты могут иметь кислый или щелочной характер. В зависимости от рН они могут быть в ионизированной или в неионизированной форме. Концентрация водородных ионов влияет также на растворимость, коэффициент распределения лекарственных веществ, а также на мембранный потенциал и поверхностную активность.
Дисперсность. Дисперсность частиц лекарственного вещества имеет не только технологическое значение, существенно влияя на сыпучесть порошкообразных материалов, насыпную массу, однородность смещения, точность дозирования и т. д. Особенно важным является то, что от размера частиц в большей степени зависят скорость и полнота всасывания лекарственного вещества при любых способах его назначения, исключая, конечно, внутрисосудистый. Таким образом, столь тривиальная технологическая операция, как измельчение, имеет непосредственное отношение к фармакотераневтическому эффекту лекарств.
Например, установлено, что при назначении сульфадимезина в виде порошка обычной степени измельчения и сверхтонкого измельчения (микроннзировашюго) в крови людей максимальная концентрация сульфаниламида достигается на 2 ч раньше в случае использования микронизированного препарата. При этом пиковые (максимальные) концентрации препарата оказываются на 40% выше, а общее количество всасывающегося сульфадимезина на 20% больше, чем при назначении порошка препарата обычной степени измельчения.
Солюбилизация. Многие вновь вводимые в лекарственный каталог вещества обладают плохой растворимостью в воде. Повысить их растворимость, а следовательно, ускорить резорбцию можно, использовав эффект солюбилизации. Солюбилизация является важным свойством растворов поверхностно-активных веществ, которое связано с их ми-целлярной структурой. В присутствии достаточных количеств поверхностно-активных веществ плохо растворимые и даже практически нерастворимые в воде органические лекарственные вещества приобретают способность коллоидно растворяться, или с о л ю б и-л а з и р о в а т ь с я. Па кафедре технологии лекарств Пятигорского фармацевтического института изучена возможность солюбилизации гидрокортизона и преднизолона и нитрофурановых производных с помощью водных растворов глицирама (моноаммонийная соль тритер-пенового сапонина глицирризиновой кислоты). Установлено, что 0,1% раствор глицирама повышает растворимость гидрокортизона и преднизолона более чем в 100 раз. При использовании 0,2% раствор глицирама в щелочной среде (1,6% NaHCO3) растворимость фурагина была повышена в 300 раз, а фурадонина — в 75 раз. В результате предложена новая водорастворимая лекарственная Форма фурагина.
 Изучалась также возможность получения водных растворов нерастворимых в воде препаратов — синтетических аналогов половых гормонов синэстрола, октэстрола, диэтилстилвбэстрола, диэтилстильбэст-рола пропионата, метилтестостерона. В качестве солюбилизатора использовались твин-80, глицирам, ОЭСШВ-35, ОЭЦС-20 и др. Результаты исследований свидетельствуют о том, что с помощью твина-80 можно повысить растворимость синэстрола в 31 раз, метилтестостерона— в 22 раза, диэтилстильбэстрола — в ПО раз.
Изучалась также возможность получения водных растворов нерастворимых в воде препаратов — синтетических аналогов половых гормонов синэстрола, октэстрола, диэтилстилвбэстрола, диэтилстильбэст-рола пропионата, метилтестостерона. В качестве солюбилизатора использовались твин-80, глицирам, ОЭСШВ-35, ОЭЦС-20 и др. Результаты исследований свидетельствуют о том, что с помощью твина-80 можно повысить растворимость синэстрола в 31 раз, метилтестостерона— в 22 раза, диэтилстильбэстрола — в ПО раз.
Солюбилизация противоопухолевых препаратов в 5% водных растворах индивидуальных и 5% бинарных водных смесях твина-80 ОП-71, ОП-10, глицирама и суммы сапонинов солодки щетинистой показала возможность получения солюбилизированных 0,5% водных растворов асалея, астирона и пальфицерина с использованием ОП-10, асалея и астирона — с твином-80. Растворимость веществ с 1:10 000 повысилась до 1: 200, т. е. в 50 раз.
Значение лекарственной формы
Лекарственное лечение неразрывно связано с вопросом выбора рациональной формы, в которой лекарственное вещество или комплекс веществ должны дать лечебный (или профилактический) эффект. Очевидно, что одновременно с расширением и изменением каталога лекарственных веществ и совершенствованием методов лечения расширялась номенклатура лекарственных форм и совершенствовалась их технология.
Очевидно, что чем большими преимуществами обладает та или иная лекарственная форма, тем большую ценность она представляет как структурная единица фармакотерапии и как промышленная единица. Лекарственная форма — это материальная форма проявления диалектического единства действующих и вспомогательных веществ и соответствующих технологических операций. Биофармация, обосновав научную трактовку лекарственной формы, требует тщательного исследования соответствия указанных компонентов (действующие и вспомогательные вещества, методы приготовления) в лекарственной форме для обеспечения оптимального действия препарата, иными словами, получения для нужд клиник наиболее рациональных лекарственных форм. В настоящее время не подлежит сомнению, что оптимальная активность лекарственного вещества достигается только назначением его в рациональной, научно обоснованной лекарственной форме.
Выбор лекарственной формы одновременно определяет и способ (путь) введения лекарства в организм. Совершенно очевидно, что скорость действия лекарственного вещества зависит от того, какой путь для его применения избран. Например, при ректальном способе лекарственное вещество может всосаться примерно через 7 мин, а при перо-ральном только через 30 мин (в среднем). Если же это вещество ввести внутривенно, то его действие проявится уже через 1—2 мин. Эффективность лекарственного вещества зависит от того, какой путь совершит лекарство до того, как оно попадает в кровь. При ректальном способе введения часть лекарственных веществ проникает в кровяное русло, минуя печень, и не подвергается химическому воздействию ее ферментов, а также желудочного сока, желчи и сока поджелудочной железы. Следовательно, сила воздействия лекарственного
 1 ОП-7 и ОП-10 — поверхностно-активные вещества, представляющие собой моно-или дналкилполнгликолевые эфиры с различным содержанием в молекуле звена (СН2—СН2О)„; у ОП-7 п = 7, у ОП-10 п=10.
1 ОП-7 и ОП-10 — поверхностно-активные вещества, представляющие собой моно-или дналкилполнгликолевые эфиры с различным содержанием в молекуле звена (СН2—СН2О)„; у ОП-7 п = 7, у ОП-10 п=10.
вещества в этом случае больше, чем при пероральном применении. При выборе пути введения учитывается также, какой характер действия ожидается от лекарственного вещества (преимущественно местное или общее, на весь организм). Все эти вопросы находят должное освещение при разборе элементов фармакокинетики.
При изучении введения цистамина гидрохлорида в организм в таблетках и суппозиториях оказалось, что препарат из суппозиториев всасывается быстрее и полнее, чем из таблеток. Было установлено, что через час после введения цистамина гидрохлорида животным из суппозиториев всасывается 85,3%, а из таблеток только 58% препарата.
Изучение биологической доступности пенных лекарственных форм препаратов солодкового корня (глицирам и др.) по сравнению с мазями на эмульсионных основах показало, что пенные аэрозоли позволяют ускорить процесс всасывания лекарственного препарата в 2—3 раза. Кроме того, препараты солодкового корня и их лекарственные формы способствуют более быстрому регрессу контактного дерматита и более выраженной тенденции к восстановлению функционального состояния кожи у животных. Препараты солодкового корня оказывают также более выраженное нормализующее влияние на метаболизм аскорбиновой кислоты и сульфгидрильных групп по сравнению с 0,5% прсднпзолоновой мазью и кремом Унны.
Значение вспомогательных веществ
С Онофармацевтической точки зрения изучение фармакологического действия любого лекарственного вещества бессмысленно, если оно не проводится в присутствии тех вспомогательных веществ, которые в дальнейшем будут составлять композицию конкретной лекарственной формы данного препарата.
Иначе говоря, вспомогательное вещество должно применяться не вообще, но конкретно с индивидуальным препаратом. Необоснованное применение вспомогательных веществ может привести к снижению, извращению или полной потере лечебного действия лекарственного вещества. Это происходит главным образом вследствие взаимодействия лекарственных и вспомогательных веществ при изготовлении лекарств в самой лекарственной форме или, чаще, после ее назначения больному. В основе подобных взаимодействий лежат преимущественно явления комплексообразования и адсорбции, способные резко изменить скорость и полноту всасывания действующих веществ.
Среди работ, посвященных изучению влияния вспомогательных веществ, особенно много внимания уделяется мазевым и суппозиторным основам. За последние десятилетия лечение мазями существенно изменились с введением в практику новых лекарственных средств, потребовавших новых мазевых основ. Большую часть последних стали составлять эмульсионные основы, применение которых обеспечивает более легкую диффузию лекарственных веществ в кожу и расширяет возможности введения лекарственных веществ как в масляную, так и в волную фазу. Значительное применение находят теперь также гидрофильные мазевые основы, хорошо переносимые больными и полно отдающие лекарственные вещества без нарушения перспирации кожи. Дифф\зшо лекарственных веществ усиливают добавками поверхностно-активных веществ, набор которых все расширяется.
Среди суппозиторных основ все большое распространение получают гидрогенизаты жирных масел, которые в сочетании с добавками поверхностно-активных веществ обеспечили не только необходимые для суппозиториев структурно-механические свойства, но и должную скорость высвобождения лекарственных веществ.
 Значение технологических факторов
Значение технологических факторов
Процесс превращении исходных лекарственных веществ (препаратов) в лекарство - это прежде всего технологический процесс. Вряд ли кто будет оспаривать тот факт, что способ получения лекарственных форм во многом определяет стабильность препарата, скорость его высвобождения нз лекарственной формы, интенсивность его всасывания и, в конечном итоге, его терапевтическую эффективность. Например, от избранного способа эмучьгировапня касторового масла зависит степень его дисперсности, а следовательно, и скорость омыления масла в щелочной среде кишечника и последующий послабляющий эффект.
Выбор способа гранулирования при получении таблеток обусловливается сохранностью многих лекарственных веществ в готовой лекарственной форме.
Значение технологических факторов особенно ярко проявилось в пролонгировании и дифференцированном проявлении лечебного эффекта. Это оказалось возможным в результате освоения техники изготовления многослойных таблеток и наложения на таблетки и драже покрытий разного назначения. Перспективными оказались проводимые на кафедре технологии лекарств Пятигорского фармацевтического института исследования по созданию лекарственных форм пролонгированного действия в виде спансул ■ (желатиновые капсулы, наполненные гранулами). Гранулы могут быть без покрытия (для немедленного всасывания и оказания начального эффекта), а также с покрытием различной толщины и растворимости. Разработка технологии этих гранул открывает широкие пути для сочетания лекарственных веществ и в других лекарственных формах (например, в таблетках).
Приведение примеров мы на этом ограничиваем, поскольку основная цель технологии лекарств — максимальное использование фармацевтических факторов для обеспечения высокого качества изготавливаемых лекарств1.
Элементы фармакокинегики
Фармакокинетика — это, если придерживаться дословного перевода, область науки, изучающая движение лекарств в организме. Содержание предмета — изучение количественных и качественных изменений лекарственных веществ в крови, других жидкостях организма и органах, а также изучение механизмов, обусловливающих эти изменения. Понятие «движение лекарства» охватывает этапы: всасывания, распределения биотрансформацпи (метаболизм) и выведения лекарственных веществ из организма.
Всасывание лекарственных веществ
Под всасыванием или абсорбцией понимают восприятие лекарственного вещества кровью или лимфой от пограничных поверхностей тела после его высвобождения из лекарственной формы (лпберации). Таким образом, для осуществления процесса всасывания вещества, если оно вводится не внутрисосудпето, необходимы два условия: 1) действующий ингредиент лекарства должен высвободиться из лекарственной формы, 2) высвобожденное вещество должно достигнуть поверх-
 1 Рекомендуемая литература: А. И. Теицова, И. С. Ажгихин. Лекарственная форма и терапевтическая активность лекарств (Введение в бнофарманшо). — Л\.: Медицина, 1974; W. A. Rilschel. Angewandte Biopliarmazie. — Stuttgart, 1973.
1 Рекомендуемая литература: А. И. Теицова, И. С. Ажгихин. Лекарственная форма и терапевтическая активность лекарств (Введение в бнофарманшо). — Л\.: Медицина, 1974; W. A. Rilschel. Angewandte Biopliarmazie. — Stuttgart, 1973.
19—163 289
йости всасывания (диффузия к месту абсорбции). Дальнейший транспорт лекарственного вещества осуществляется пассивным (диффузия и конвекция) и активным путем (функция тканей п клеток организма).
Если кинетика высвобождения действующего вещества из лекарственной формы в полной мерс зависит от избранного комплекса фармацевтических факторов, то дальнейший транспорт его зависит от вида, строения, физиологического состояния слизистых оболочек, кожных покровов, мышечной ткани и т. д.
Действие лекарственного вещества представляет собой результат взаимодействия его с клетками соответствующих тканей того или иного органа и, в конечном счете, всего организма. Следовательно, первый этап транспорта молекул лекарственного вещества с поверхности всасывания начинается с проникновения его через клеточную мембрану. Этот вид транспорта лекарственного вещества, известный под названием пермеацни, может протекать путем диффузии и конвекции (пассивный транспорт).
Диффузия. Движущей силой этого процесса является разность концентраций с внешней (Са) и внутренней (Ci) стороны мембраны. Если перенос вещества идет через беспоровую мембрану, транспортный поток (q) прямо пропорционален коэффициенту распределения (f) между мембранным материалом и растворителем поверхности мембраны (F) и обратно пропорционален толщине мембраны (d). Константа диффузии (D) характеризует диффузибельность молекул в данный мембранный материал.
Для диффузионного переноса выведено следующее математическое уравнение:
q = D.-j-f(Ca~Ci).
При конвекции перенос растворимых молекул осуществляется под влиянием движения растворителя. Интенсивность и направленность движения определяются разницей давлений между внешней (Ра) и внутренней (Pi) стороной мембраны. Если транспорт осуществляется через поры, то транспортный поток (q) пропорционален не только поверхности (F) отдельных пор и их числу (п), но также квадрату радиуса пор (г) и обратно пропорционален длине пор (d), т. е. толщине мембраны. Константа (ц) вязкости характеризует специфическое состояние раствора.
1 nr"-F
Рр
Какой вид переноса имеет нермсация, будет зависеть от строения и свойств клеточной мембраны. Различают четыре типа клеточных мембран.
Тип 1: мембрана имеет поры. Вещество мембраны непроницаемое для молекул лекарственного вещества. Возможны конвекция (в основном) и диффузия через заполненные водой поры.
Тип 2: мембрана не имеет пор. Возможна только диффузия. Предпосылкой для переноса (проницаемости) может служить растворимость молекул лекарственного вещества в веществе мембраны. В основном к диффузии через такую мембрану способны лишь липоидо-растворимые неионизированные молекулы, тогда как ионизированные молекулы через нее не проникают.
Тип 3: мембрана сочетает строение и свойства предыдущих двух мембран: имеются поры и слои полупроницаемы. Такие мембраны бо-
 лее универсальны для транспорта молекул лекарственных веществ. Поры могут иметь электрические заряды или не иметь их. Через эти заряды могут диффундировать молекулы — неэлектролиты. Поры могут быть относительно крупнее, чем в мембранах типа 1, и пропускать молекулы с относительно большой молекулярной массой. Мембраны с такими порами находятся, в частности, в почечных клубочках.
лее универсальны для транспорта молекул лекарственных веществ. Поры могут иметь электрические заряды или не иметь их. Через эти заряды могут диффундировать молекулы — неэлектролиты. Поры могут быть относительно крупнее, чем в мембранах типа 1, и пропускать молекулы с относительно большой молекулярной массой. Мембраны с такими порами находятся, в частности, в почечных клубочках.
Тип 4: мембраны без пор, обеспечивающие активный транспорт с помощью молекул специфических веществ, выполняющих функцию переносчиков — «носителей». Конкретные механизмы активного переноса веществ через такие мембраны еще находятся в стадии выяснения.
Активный перенос крупных и труднорастворимых молекул лекарственных веществ (гормоны, ферменты и др.) внутрь клетки может происходить с помощью движения мембраны и образования вокруг них ультрамикроскопичеекнх пузырьков (вакуолей). Такой механизм активного захватывания молекул вещества и последующего их транспорта через плазматическую мембрану получил название пиноцитоза. Из всего сказанного видно, что мембраны представляют собой важное образование, поскольку им принадлежит главная роль в фармако-кинетике лекарственных веществ на первом ее этапе.
К пораженному патологическим процессом органу лекарственное вещество доставляется посредством транспортной системы — крови. Однако путь, который должно пройти лекарственное вещество от клетки (ткани) до этой основной транспортной системы (имеется в виду не внутривенное введение), находится в прямой зависимости от пути введения лекарственного вещества в организм.
Из мышечной ткани (при внутримышечном введении) растворы лекарственных веществ хорошо проникают в кровь и уже через 5— 10 минут могут создать достаточную концентрацию их в крови. Из подкожной клетчатки (при подкожном введении) лекарственные вещества проникают несколько медленнее из-за меньшего кровообращения в ней. Аэрозольные формы лекарственных веществ вследствие распространения их на большой поверхности слизистой оболочки рта, глотки и верхних дыхательных путей всасываются в кровь быстро.
Пероральный путь введения лекарственных веществ является наиболее привычным и распространенным. В связи с этим вопросам всасывания лекарственных веществ через слизистые оболочки желудочно-кишечного тракта уделяется особенно много внимания. Всасывание лекарств из желудочно-кишечного тракта — процесс очень сложный. Связь этого процесса с растворимостью веществ не всегда можно с определенностью предсказать. Недостаточная абсорбция часто объясняется малой стабильностью препаратов в кислом содержимом желудка или в щелочной среде тонкого кишечника. Во многих случаях наличие пищи в желудочно-кишечном тракте ограничивает скорость всасывания. Не меньшее значение должно придаваться также взаимодействию лекарств с компонентами пищеварительной трубки — муцином, энзимами и различными протеинами, солями желчных кислот, составными частями химуса.
Муцин, выстилая пленкой поверхность слизистых оболочек желудка и кишечника, благодаря высокой вязкости и своеобразию химического строения (полисахаридное соединение) представляет серьезный барьер на пути диффузии многих лекарственных веществ, образуя, например, со стрептомицином, и некоторыми антихолинэргическими и гипотензивными средствами, плохо диффундирующие комплексы. Энзимы и другие активные белки могут вызывать гидролиз многих соединений. Желчные кислоты усиливают процессы всасывания трудно растворимых лекарственных веществ, поскольку они обладают высо-
19* 291
кой солюбилизирующей активностью. С другой стороны они же являются причиной образования трудноднффупдпрующих комплексов (например, с неомицином, канамицином) и даже вызывать инактивацию некоторых лекарственных веществ (например, нистатина, полимик-спна).
Полпота всасывания лекарственных веществ после введения их внутрь практически всегда значительно ниже, чем после парентерального введения, и, кроме того, подвержена гораздо большим колебаниям даже у одного и того же лица. Тем не менее несомненные удобства перорального использования лекарств заставляют изыскивать лекар-п ценные формы, пригодные для назначения внутрь. Кроме того, концентрация препаратов is крови после перорального применения, как правило, хотя и несколько ниже, чем после парентерального, но зато более стабильна. Инъекционные способы введения предпочтительны при необходимости достижения очень быстрого эффекта.
Широкое распространение приобрел ректальный путь введения лекарственных веществ. Венозная кровь от прямой кишки по системе нижних и средних геморроидальных вен поступает в общий кровоток, минуя печеночный барьер; это обстоятельство уменьшает деструкцию молекул лекарственного вещества. С другой стороны, слизистая оболочка прямой кишки хорошо всасывает растворимые в воде и растворимые в жирах лекарственные вещества. Поэтому уже через 5— If) минут после введения лекарственного вещества per-rectum в крови создается его минимальная терапевтическая концентрация.
Распределение лекарственных веществ в организме
Под этим процессом понимается распределение лекарственных веществ как в транспортирующих средах — дистрибуция (Distribution), так и в организме в целом — инвазия (.Invasion). Лекарственные вещества, поступившие в кровь любыми путями, находятся в растворенном состоянии в солевом составе крови в свободном состоянии и в связанном с форменными элементами крови, белками, липопротси-дамп. Лекарственные вещества разносятся кровью по всему организму и равномерно распределяются во всем объеме крови до установления состояния подвижного равновесия в соответствующем органе. Через органы с интенсивным кровообращением (сердце, легкие, мозг, печень) протекает большое количество крови, а вместе с ней, следовательно, будет больше протекать и лекарственных веществ.
Для наступления специфического действия лекарственного вещества необходимо достижение минимальной его концентрации в организме, которая определяется как минимальная лечебная доза (начальная доза). Дальнейшее усиление реакции организма на введенное вещество будет зависеть от увеличения его количества до эффективной лечебной дозы и от того как долго избранная лекарственная форма сможет обеспечить стабильную концентрацию.
Кинетика содержания препарата в крови. Наблюдения свидетельствуют о том, что длительность лекарственного эффекта коррелирует с продолжительностью циркуляции препарата в плазме, несмотря на то, что местом приложения действия фармакологически активных веществ (исключая гематотропные вещества) являются фактически ре-цепторные образования других тканей, а не кровь.
Основные фармакокинетические параметры кинетики содержания препаратов в крови: время достижения и высота максимального уровня (пик), скорость и характер снижения концентраций, длительность циркуляции в определимых или, что более важно, терапевтических концентрациях.
Т
 Кинетика содержания в тканях-- наименее изученная из фармако-кпнетических характеристик. В большинстве случаев действие лекарств осуществляется вневаскулярно. Тем не менее есть все основания предполагать, что дальнейшее развитие фармакокинетики особенно химиотерапевтических препаратов неизбежно связано с преимущественным вниманием к вопросам распределения препаратов в тканях н органах.
Кинетика содержания в тканях-- наименее изученная из фармако-кпнетических характеристик. В большинстве случаев действие лекарств осуществляется вневаскулярно. Тем не менее есть все основания предполагать, что дальнейшее развитие фармакокинетики особенно химиотерапевтических препаратов неизбежно связано с преимущественным вниманием к вопросам распределения препаратов в тканях н органах.
В качестве основных показателей способности лекарств проникать из крови в ткани принимаются следующие факторы: величина и время достижения максимального уровня в ткани, скорость и характер снижения содержания, длительность поддержания определенных (терапевтических) концентраций, величина концентрационного градиента (отношение концентрации вещества в ткани к содержанию его в крови) в ранние сроки после введения, а также изменение этого показателя во времени. Как правило, в начальном периоде циркуляции лекарственного вещества его тканевые концентрации ниже сывороточных, затем они выравниваются и, наконец, превышают концентрации в крови. В количественном выражении эти соотношения могут варьировать в больших пределах и зависят, в частности, от диффузионных свойств препаратов. При определении веществ в тканях вносится поправка на инактивирующее (во многих случаях выраженное) влияние на них биологических субстратов.
С целью получения возможно большей информации о распределении лекарственных веществ в организме в последнее десятилетие все шире стали использовать математические модели распределения. Ценность получаемой при этом информации зависит от степени соответствия избранной модели условиям опыта.
Биотрансформация (метаболизм)
Метаболизм (греч. mctabole — изменение) —это сумма химических превращений, которые претерпевает лекарственное вещество в организме. Эти процессы принято рассматривать как частный случай явления детоксикации, ведущего к образованию продуктов, легко удаляемых из организма почками. В большинстве случаев биотрансформация сопровождается образованием метаболитов, менее активных или полностью лишенных активности, присущей исходному соединению. В большинстве случаев химические превращения лекарств осуществляются в печени, но ферменты, принимающие участие в их метаболизме, могут также находится в крови или других тканях. Биотрансформация лекарственных препаратов в организме характеризуется кинетикой содержания их метаболитов в плазме крови, моче, желчи и тканях.
В плазме крови биотрансформация может проявляться также связыванием (адсорбцией) лекарственных веществ белками крови. Изредка в процессе метаболизма образуются более активные лекарственные вещества или, что более опасно, токсические соединения. Например, токсичность метилового спирта зависит от того, что его метаболитами (при окислении в организме) являются формальдегид и муравьиная кислота.
Выведение лекарственных веществ из организма
Заключительным этапом пребывания лекарственного вещества в организме является выведение его или его метаболитов из крови. Процесс этот носит еще название элиминации. Осуществляется она двумя путями: 1) за счет почечного выделения и 2) путем экстрареналыюй экскреции (внепочечпое выделение).
Почечная экскреция наиболее распространенный вид элиминации лекарственных веществ. Многие вещества выводятся ирсимуществен-
но с мочой, где их концентрации значительно превышают таковые в плазме крови. Ультрафильтрация в клубочках почек является необходимым компонентом экскреции всех циркулирующих в крови веществ. Некоторые лекарственные вещества (например, сульфаниламиды) могут подвергаться обратному всасыванию из ультрафильтрата в почечных канальцах, что способствует более длительной циркуляции вещества в организме. Другие препараты (например, пенициллины), наоборот, обладают способностью секретиронаться в канальцах почек, что соответственно ускоряет их элиминацию.
Внепочечная экскреция играет, как правило, вспомогательную роль в элиминации лекарств из организма. Однако для некоторых препаратов, в частности антибиотиков, выведение из организма с желчью может иметь решающее значение в механизмах плазматического очищения. Экскретпровапныс в просвет кишечника соединения часто способны вновь всасываться в кровь. Образующийся таким образом ки-шечпо-печепочнып кругооборот является фактором, способствующим удлинению циркуляции препарата в организме. Другие пути экстраре-налыюй экскреции, например выделение с молоком, слезами, слюной, потом, менее существенны для фармакокпнетпческой характеристики препаратов. Тем ис менее они в ряде случаев также принимаются во внимание.
Биологическая доступность лекарственных веществ
Критерием оценки степени влияния отдельных пли суммы фармацевтических факторов на активность лекарственного средства является тсстомологическая (физиологическая) доступность препаратов. Биологическая доступность фактически характеризует качество лекарства. Мерой биологической доступности (БД) служит отношение (в процентах) количества всасывающегося лекарственного вещества, назначенного в исследуемой лекарственной форме (S), к количеству того же лекарственного вещества, назначенного и топ же дозе, но в виде стандартной лекарственной формы (Si). Биологическая доступность может быть определена по следующей формуле:
S-100
БД------ о—.
Стандартной лекарственной формой является внутривенная инъекция как обеспечивающая немедленное и полное поступление лекарственного вещества в большой круг кровообращения. Таким путем определяется абсолютная биологическая доступность. Более распространено и, возможно, более целесообразно определение относительной биологической доступности. Для этой цели стандартными лекарственными формами служат раствор или другая лекарственная форма для приема внутрь, которая хорошо охарактеризована и хорошо всасывается.
Обычно биологическую доступность устанавливают, определяя экскрецию лекарственного вещества с мочой (за известный промежуток времени после назначения препарата) или концентрацию препарата в крови после однократного или многократного его назначения. Однако имеются лекарства, биологическую доступность которых нужно определять иначе, например при нанесении на кожные покровы (мази, линименты, пластыри) или на слизистую оболочку прямой кишки (суппозитории) и влагалища (глобули). При определении биологической доступности лекарственного вещества любым методом требуется точное выполнение ряда условий, важнейшими из которых являются время взятия жидкостей для анализа и частота забора проб.
 Биологическую доступность лекарства можно определять у здоровых людей — добровольцев. Такими могут быть мужчины в возрасте от 20 до 40 лет, у которых отсутствуют заболевания желудочно-кишечного тракта, печени, почек, сердца и щитовидной железы. По крайней мере за 1 нед до начала исследования добровольцы прекращают прием других лекарств, а за 1 мес — прием препаратов, влияющих на активность ферментов и гормонов. Добровольцы не принимают пищу (или пользуются только специально подобранной диетой) за 4—12 ч до постановки опыта и еще в течение 2 ч после приема лекарства. Строгая стандартизация распространяется и на другие условия эксперимента: количество выпитой воды (влияние на подвижность желудочно-кишечного фактора), рН мочи (воздействие на кинетику выведения лекарственных веществ), физическую активность и положение тела (состояние беспокойства, а тем более стресс) и др.
Биологическую доступность лекарства можно определять у здоровых людей — добровольцев. Такими могут быть мужчины в возрасте от 20 до 40 лет, у которых отсутствуют заболевания желудочно-кишечного тракта, печени, почек, сердца и щитовидной железы. По крайней мере за 1 нед до начала исследования добровольцы прекращают прием других лекарств, а за 1 мес — прием препаратов, влияющих на активность ферментов и гормонов. Добровольцы не принимают пищу (или пользуются только специально подобранной диетой) за 4—12 ч до постановки опыта и еще в течение 2 ч после приема лекарства. Строгая стандартизация распространяется и на другие условия эксперимента: количество выпитой воды (влияние на подвижность желудочно-кишечного фактора), рН мочи (воздействие на кинетику выведения лекарственных веществ), физическую активность и положение тела (состояние беспокойства, а тем более стресс) и др.
Принципиально биологическую доступность лекарственного вещества можно определять и на больных, нуждающихся в данном лекарстве. Однако по практическим соображениям и из-за ограниченности знаний о влиянии болезни на биологическую доступность от таких испытаний в настоящее время воздерживаются.
В связи со сложностью определения биологической доступности лекарственных средств и этическим соображениям испытания стремятся проводить на моделях — на животных (in vivo) и путем постановки тестов in vitro. Одна из основных задач экспериментальной биофармации состоит в том, чтобы разработать такие тесты in vitro и такие модели in vivo иа животных, которые позволили бы сопоставлять полученные результаты с результатами исследований человека и были бы значимыми благодаря выявленной беспорной корреляции. Такие тесты и модели открывают широкие возможности не только для установления биологической доступности при разработке нового лекарства и изучении влияния отдельных фармацевтических факторов, но при текущем контроле качества лекарств.
Определение биологической доступности лекарственных веществ методами in vitro
Методы in vitro позволяют судить о биологической доступности лекарственного вещества по его конкретному количеству, высвободившемуся из той или иной лекарственной формы.
В связи с установлением в большинстве случаев корреляции между скоростью растворения и скоростью всасывания лекарственных веществ метод определения скорости растворения может рассматриваться как основной метод определения эффективности высвобождения растворимых лекарственных веществ из лекарственных форм.
Высвобождение лекарственного вещества базируется также на процессе диффузии.
Методы определения эффективности высвобождения лекарственных веществ применимы для всех пероральных и формированных ректальных лекарственных форм. С целью использования этого метода в настоящее время предложено много приборов различной конструкции.
В основе всех методов растворения лежат принцип дезинтеграции лекарственной формы (механическое разрушение) и диффузия включенного в нее лекарственного вещества в растворяющую среду. Растворяющей средой может быть вода или жидкость, имитирующая ту или иную биологическую жидкую среду (желудочный сок, кишечный сок и т. д.). В ряде конструкций приборов растворяющая среда не удаляется и», емкости прибора па протяжении всего времени определения; в других конструкциях по мере высвобождения (растворения) вещество периодически удаляется из емкости прибора. В приборах
 первого типа необходимый для процесса растворения и диффузии переход концентрации достигается путем естественной или принудительной (большей частью перемешиванием) конвекции растворяющей среды. В настоящее время в научных и практических (контрольно-аналитическая служба) биофармацевтических исследованиях наибольшее распространение нашли методы и приборы, позволяющие осуществить периодическое удаление высвободившегося лекарственного вещества.
первого типа необходимый для процесса растворения и диффузии переход концентрации достигается путем естественной или принудительной (большей частью перемешиванием) конвекции растворяющей среды. В настоящее время в научных и практических (контрольно-аналитическая служба) биофармацевтических исследованиях наибольшее распространение нашли методы и приборы, позволяющие осуществить периодическое удаление высвободившегося лекарственного вещества.
Приборы подобного рода сложны по конструкции и работают на основе адсорбционного, разделительного и диализного методов. Адсорбционный метод основан на поглощении растворяющегося препарата адсорбентами (активированный уголь, бентониты и т. д.) при последующем определении препарата в отфильтрованном адсорбенте. При разделительном методе используется способность полного перехода высвобождающегося в водной фазе препарата в органический растворитель с другой плотностью (например, хлороформом). Диализный метод является наиболее простым, широко распространенным и в аппаратурном оформлении самым разнообразным. Метод пригоден для любых лекарственных форм с водорастворимыми препаратами. Обычно в качестве диализной мембраны используют пленки из натуральных или полимерных материалов различной природы (переживающая кожа животных, стенка желудка и кишки, яичная оболочка, целлофан, поливинилхлорид, пленки из ацетата целлюлозы, полиамида и т. д.). В качестве среды, в которую диализируют лекарственное вещество, можно применять воду: изотонический раствор хлорида натрия, раствор Рингера и т. д. Процесс обычно ведется в термостате при 37 °С. Аппаратурное оформление может быть различным.
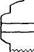
Очень простая конструкция прибора для диффузионного высвобождения лекарственных веществ была предложена Мюллеманом и Не-иеншвандером. Прибор (рис. 114) представляет собой стеклянную трубку длиной 15 см, сечением 10 см2, на один конец которой крепят целлофановую мембрану. Диализную трубку с мембраной опускают на глубину 2—3 мм в термостатированный сосуд (химический стакан емкостью 250 мм) с 30 мл дистиллированной воды (или другой среды). После достижения температуры 37±0,5°С на целлофановую мембрану опускают или равномерно наносят исследуемую лекарственную форму. Отбор проб диализа в каждом случае производят с помощью пипетки через равные интервалы времени с момента начала диализа, немедленно возвращая взятое количество чистого растворителя в диализатор. Объем каждой пробы равен 5 мл. Взятые пробы анализируют химическими или физико-химическими методами.
В настоящее время определение скорости растворения (высвобождения) препаратов в качестве практически первого этапа определения биологической доступности введено в Фармакопею США (USP XVIII, с. 934) и Национальный формуляр (NF XIII, с. 802). В указанные кодексы уже включено 12 статей, касающихся препаратов, для которых определение скорости растворения является обязательным.
Прибор для определения скорости растворения (рис. 115) представляет собой трехгорлый сосуд из пластмассы емкостью 1 л. В один из тубусов (1) вводят термометр, в другой (2) —стеклянную трубку для взятия проб и их комплекенрования, а в третий (<?) — основную деталь прибора — цилиндрическую корзинку (4) высотой 3,6 см и диаметром 2,5 см, сделанную из нержавеющей стали в виде сетки с отверстиями диаметром 40 меш (около 0,351 мм). Корзинка насажена на ось мотора (5).
В сосуд наливают рпстпоряющую среду (750—000 мл), в качестве которой в зависимости от природы препарата используют дистиллиро-
29(3
Г
 | |||
 |
|
Sp-Юсм2
| 1__ | ||
| - <т-- | ||
2
|
К
Ьсм
Рис. 114. Схема устройства для определения скорости высвобождения лекарственного вещества путем диализа через пленку. Объяснение в тексте.
Рис. 115. Схема прибора Фармакопеи США для определения скорости высвобождения растворимых лекарственных веществ. Объяснение в тексте.
ванную воду, раствор хлористоводородной кислоты различной концентрации, буферные растворы и т. д. Исследуемую лекарственную форму помещают в цилиндрическую корзинку, которую устанавливают на расстоянии 2 см от дна сосуда. Температуру растворяющей среды во время опыта поддерживают постоянной (37+0,5°С). Скорость вращения корзинки в среде регулируют с точностью ±5%, она составляет от 25 до 200 об/мин в зависимости от свойств препаратов. Через установленные интервалы времени отбирают для анализа пробы по 2— 3 мл для определения содержания лекарственного вещества. Взятый объем растворителя тотчас же восполняют новым. Исследуемая лекарственная форма соответствует требованиям на скорость высвобождения в том случае, если за установленные интервалы времени из нее перешло в раствор требуемое количество лекарственного препарата.
Определение биологической доступности лекарственных веществ методами in vivo
В опытах in vivo определяют содержание лекарственных веществ или метаболитов в крови или интенсивность выделения их из организма животных.
Исследования обычно проводят на крупных лабораторных животных— собаках, кроликах и др. Препарат вводят в соответствии со спецификой топ или иной лекарственной формы из расчета определенного количества на 1 кг массы тела животного. После забора проб (кровь, моча) через определенные промежутки времени определяют
количественное содержание в них препарата. По скорости всасывания или выделения лекарственного вещества или его метаболитов из организма судят о рациональности технологических процессов, лекарственной формы. Как указывалось выше, исследования биологической доступности проводят в форме сравнительных экспериментов, в которых лекарственное вещество сравнивают со стандартной лекарственной формой того же лекарственного вещества. Стандартной лекарственной формой может быть раствор, вводимый внутривенно (при определении абсолютной биологической активности) или иным способом (в исследованиях относительной биологической доступности).
Помимо оценки биологической доступности по общему количеству лекарственного вещества или его метаболитов, выделившихся с мочой, о ней можно судить при измерении всей области, которую занимает кривая, характеризующая изменение концентрации лекарственного вещества в плазме во времени. Эту область можно определить с помощью соответствующей методики численного интегрирования, например с помощью формулы трапеции.
В заключение можно сказать, что знание основ биофармации во взаимосвязи с фармакокинетикой:
1) позволяет выяснить оптимальные пути введения лекарственных
веществ в организм. Выбор путей введения зависит от результатов;
2) облегчает определение рациональных дозировок лекарственных
веществ для использования их в лечебной практике. Однако перенос
экспериментальных данных с животных на человека не может быть
основан на каких-либо универсальных закономерностях; он индиви
дуален в каждом отдельном случае;
3) дает возможность уточнить показания и противопоказания к при
менению лекарственных веществ. Например, вещества, хорошо прони
кающие через гематоплацентарныи барьер, не следует применять при
беременности. Антимикробные препараты, активно экскретирующиеся
почками или накапливающиеся в печени, пригодны для лечения ин
фекций мочевых или желудочных путей. При менингитах целесооб
разно назначать вещества, хорошо проникающие из крови в ликвор
и т. д.;
4) облегчает и ускоряет направленный поиск новых препаратов
с желаемыми закономерностями распределения в организме, а в не
которых случаях и с более высокой или более широкой активностью,
например при выявлении метаболитов, обладающих преимуществами
перед исходным веществом по специфической активности и, что осо
бенно существенно, для фармацевтической технологии;
5) позволяет обосновать применение фармацевтических факторов
в производстве лекарств. Особого внимания заслуживает связь между
фармакокинетикой и изысканием новых лекарственных форм, модер
низацией ныне применяемых, а также пролонгированием и стабилиза
цией лекарств.
ГЛАВА 27
РАЦИОНАЛЬНОСТЬ ЛЕКАРСТВЕННОЙ ПРОПИСИ
И ПРОБЛЕМА СОВМЕСТИМОСТИ ЕЕ ИНГРЕДИЕНТОВ
Общие понятия
о несовместимых сочетаниях лекарственных средств
В самом существе лекарственной прописи (рецепте) заложены элементы целесообразности и рациональности. Составляя рецепт, врач стремится создать такое лекарство, которое было бы разумно не только по подбору лекарственных веществ, но и по совместимости в из-
бранной лекарственной форме. При этом имеется ввиду совместимость всесторонняя: физическая, химическая и фармакологическая. Однако в практике аптечной работы имеют место случаи поступления рецептов, не отвечающих указанным высоким требованиям. Иногда врач решает задачу подбора нужных лекарственных веществ односторонне, в отрыве от второй задачи — возможности их сочетания. В результате этого несоответствия появляются нерациональные или несовместимые п р о и ис и.
Если причиной несовместимости служат явления физического порядка (например, отсыревание порошков, расслоение эмульсий и т. п.), то такие нерациональные прописи называют физическими нссов-местимостями. В тех случаях, когда в основе нерациональности прописей лежат химические явления, т. е. прописанные вещества реагируют между собой, в результате чего появляются новые вещества, с новыми свойствами, прописи называют химическими несовмести-мостями. Наконец, несовместимость лекарственных препаратов, обнаруживаемую в живом организме, принято условно называть собирательным термином фармакологическая несовместимость.
В зависимости от того, как велика допущенная врачом ошибка, изменяется и характер нерациональности прописи. Если в результате физико-химического или химического взаимодействия лекарственных веществ друг с другом образовались новые вещества, то следствием этого может быть: 1) ослабление или даже полное исчезновение лечебных свойств, типичных для данного лекарства; 2) появление у смеси новых, другого направления (невредных) свойств; 3) появление новых вредных и, что самое опасное, ядовитых свойств. Все это разнообразие последствий и послужило причиной появления в некоторых руководствах тенденции к разделению несовместимых сочетаний на две группы — нерациональных и несовместимых.
В вопросе о несовместимых сочетаниях советский фармацевт должен стоять на одной, единственно верной позиции: из аптек можно отпускать только полноценные лекарства. Фармация социалистического государства, опирающаяся на передовую науку, может и должна избавиться от нерациональных прописей. Уместно еще раз напомнить о правилах выписывания рецептов, согласно которым любой рецепт, содержании! несовместимые лекарственные вещества, считается недействительным и лекарство по нему не приготовляется.
«Рецептура» несовместимых сочетаний подвержена изменениям. По мере эволюции каталога лекарственных средств изменяются и случаи несовместимости. Так, нерациональные прописи, типичные для дореволюционной рецептуры, теперь могут совсем не встречаться. В настоящее время не исключена возможность эпизодических «вспышек» несовместимых сочетаний на короткий период, пока врачи не освоят рецептуру новейших лекарственных средств, вызвавших эти «вспышки». Задача провизора — оказать необходимую консультацию врачу и способствовать быстрейшей ликвидации этих временно возникающих аномалий1.






