В окислительно-восстановительной реакции химический эквивалент определяется как реальная или условная частица вещества, которая эквивалентна одному электрону.
Фактор эквивалентности 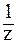 в окислительно-восстановительных реакциях определяется числом электронов (n), принятых или отданных одним атомом, ионом или молекулой окислителя или восстановителя (z = n).
в окислительно-восстановительных реакциях определяется числом электронов (n), принятых или отданных одним атомом, ионом или молекулой окислителя или восстановителя (z = n).
Для КМnО4 факторы эквивалентности 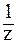 в кислой, нейтральной и щелочной средах соответственно равны
в кислой, нейтральной и щелочной средах соответственно равны 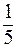 ,
,  и 1.
и 1.
Таким образом, молярные массы эквивалентов КМnО4 в различных средах составляют:
| Среда | кислая | нейтральная | щелочная |
M( KMnO4), г/моль KMnO4), г/моль
| 
| 
|
Ниже приведены полуреакции окисления некоторых восстано-вителей, используемых в оксидиметрии, и расчет их молярных масс эквивалента:
Fe2+ – 1ē  Fe3+,
Fe3+,
 ;
;
H2O2 – 2ē  O2 + 2H+,
O2 + 2H+,
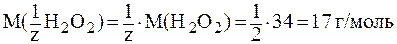 ;
;
Н2C2O4 – 2ē  2CO2 + 2H+,
2CO2 + 2H+,
 ;
;
C2O42- – 2ē  2CO2,
2CO2,
 ;
;
2S2O32- – 2ē  S4O62-,
S4O62-,
здесь на один ион тиосульфата приходится один отданный электрон, поэтому:
 .
.






