При титровании водного раствора аммиака раствором HCl точке эквивалентности соответствует значение рН = 5, а скачок рН находится в интервале от 4 до 6, т.е. в кислой среде (рис. 3). Это объясняется тем, что в результате реакции образуется хлорид аммония, раствор которого вследствие гидролиза имеет кислую реакцию среды:
NH3×H2O + HCl ⇄ NH4Cl + H2O
Здесь для фиксирования точки эквивалентности пригодны индикаторы, меняющие окраску в области значений рН от 4 до 6. В частности, может быть использован метилоранж ( = 4, интер-вал от 3,1 до 4,4). Применение индикатора фенолфталеин (
= 4, интер-вал от 3,1 до 4,4). Применение индикатора фенолфталеин ( = 9, интервал от 8 до 10) приведет к заниженным результатам титрования, а индикатора тимоловый синий (
= 9, интервал от 8 до 10) приведет к заниженным результатам титрования, а индикатора тимоловый синий ( = 1,7, интервал от 1,2 до 2,8) - к завышенным.
= 1,7, интервал от 1,2 до 2,8) - к завышенным.
Аналогичный вид имеют и кривые титрования растворов солей, имеющих щелочную реакцию среды (например, Na2CO3) сильными кислотами.
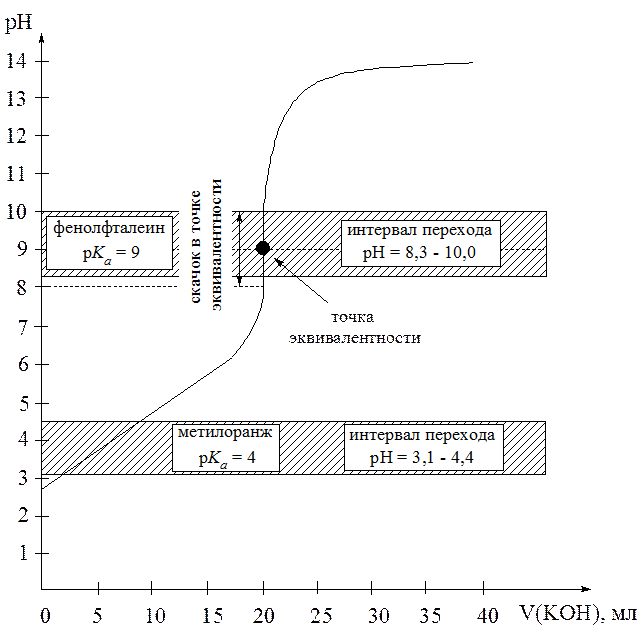
Рис. 2. Кривая титрования слабой кислоты (CН3COOH) сильным основанием (KOH). С(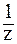 CН3COOH) = 0,1 моль/л, С(
CН3COOH) = 0,1 моль/л, С(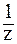 KOH) = 0,1 моль/л.
KOH) = 0,1 моль/л.
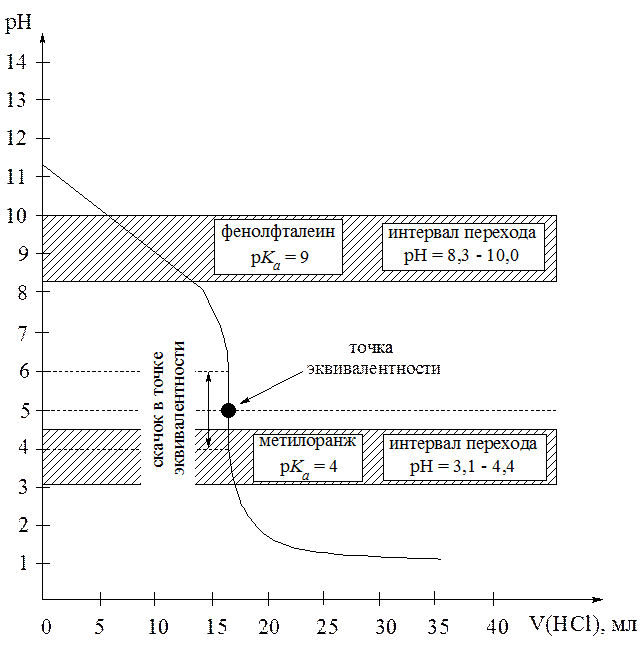
Рис. 3. Кривая титрования слабого основания (NH3×H2O) сильной кислотой (HCl). С(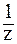 NH3×H2O) = 0,1 моль/л, С(
NH3×H2O) = 0,1 моль/л, С(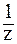 HCl) = 0,1 моль/л.
HCl) = 0,1 моль/л.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ОКСИДИМЕТРИЯ






