Твердые растворы – однородные кристаллические вещества, состоящие из двух или большего числа компонентов и сохраняющие однородность при изменении соотношений между компонентами в определенном интервале концентраций. В твердых растворах атомы одного или нескольких компонентов находятся в кристаллической решетке одного из компонентов, который называется растворителем.
Различают твердые растворы замещения, внедрения, вычитания. В твердых растворах замещения, образованных двумя или несколькими металлами (например, медью и никелем), атомы одного металла (Ni) размещаются в узлах кристаллической решетки другого (Cu) вместо атомов Сu. В твердых растворах внедрения атомы неметалла (обычно) располагаются в промежутках между атомами металла, которые находятся в узлах кристаллической решетке. Твердые растворы вычитания образуются только на основе химических соединений. При растворении компонента А в химическом соединении А и В, часть узлов решетки, принадлежащих компоненту В, делается вакантной (вычитается из решетки).
Твердые растворы обозначаются греческими буквами: a, b, g, d и т.д.
В сплавах имеются структурные составляющие: эвтектика и эвтектоид.
Эвтектика – тонкая смесь кристаллов различных компонентов или фаз, одновременно закристаллизовавшихся из жидкости определенного (эвтектического) состава при температуре ниже температуры плавления отдельных компонентов.
Эвтектоид – аналогичная эвтектике структурная составляющая металлических сплавов, но в отличие от нее образующаяся не из жидкой, а из твердой фазы.
2.2. ПОСТРОЕНИЕ ДИАГРАММ СОСТОЯНИЯ
Сущность термического метода построения диаграммы состояния сводится к определению критических температур при нагревании или охлаждении металлов и сплавов. Критическими называются температуры, при которых происходят фазовые превращения в сплаве (начало и конец кристаллизации, полиморфные превращения и другие).
В процессе охлаждения сплава (рис.1.) вначале скорость охлаждения велика, затем она уменьшается, т.к. происходит кристаллизация одной из фаз, при которой выделяется некоторое количество тепла. При кристаллизации

эвтектики происходит остановка охлаждения (площадка на кривой охлаждения), так как выделяемое тепло, в связи с кристаллизацией двух и более фаз одновременно, полностью компенсирует теплоотвод.
При охлаждении сплавов с различным содержанием компонентов получают ряд кривых, изображающих ход процесса охлаждения сплава.
Для двухкомпонентных систем при построении диаграмм по оси ординат откладывается температура, по оси абсцисс - концентрация элементов в сплаве (рис.2).
Общее содержание компонентов в сплаве 100 %, и поэтому каждой точке на диаграмме соответствует определенное содержание компонентов.
Критические температуры начала и конца кристаллизации, полученные при охлаждении сплавов, переносятся на координатные оси "температура-концентрация". Затем плавными линиями соединяются точки начала и конца кристаллизации сплавов. При наличии эвтектики в сплаве точки конца кристаллизации сплавов располагаются на одной прямой при температуре кристаллизации эвтектики (рис.2.4).
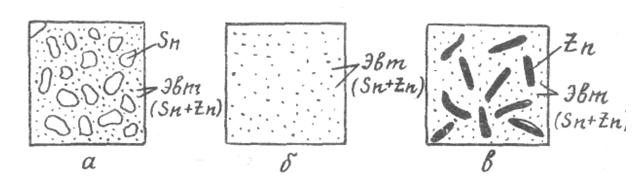 Сплавы на, диаграмме состояния, располагающиеся до точки эвтектики (слева направо), называются доэвтектическими, соответствующие точке эвтектики - эвтектическими, располагающиеся за точкой эвтектики - заэвтектическими. Структура этих сплавов на примере системы Zn-Snпоказана на рис.2.3.
Сплавы на, диаграмме состояния, располагающиеся до точки эвтектики (слева направо), называются доэвтектическими, соответствующие точке эвтектики - эвтектическими, располагающиеся за точкой эвтектики - заэвтектическими. Структура этих сплавов на примере системы Zn-Snпоказана на рис.2.3.
Рис. 2.3. Схематическое изображение структуры системы олово-цинк:
2.3. АНАЛИЗ ДИАГРАММ СОСТОЯНИЯ
По диаграмме состояния можно определить критические точки сплава при нагревании и охлаждении и установить его структуру, выбрать сплав, обладающий наилучшими литейными свойствами, правильно назначить режим термической обработки.
Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют эвтектику (рис. 4):
АЕС - ликвидус, начало кристаллизации сплавов.
ВЕF - солидус, конец кристаллизации сплавов; на этой линии происходит одновременная эвтектическая кристаллизация компонентов А и В при постоянной температуре. Линия называется эвтектической.
АЕ - начало кристаллизации компонента А.
ЕС - начало кристаллизации компонента В.
Точка Е называется эвтектической, в ней происходит одновре-
менная кристаллизация компонентов при самой низкой и постоянной
температуре.
Кристаллизация и структурообразование сплавов
Сплав I - доэвтектический. Критическая точка I - начало кристаллизации компонента А, две фазы: жидкость и зародыши зерен компонента А.
Критическая точка 2- кристаллизация эвтектики, т.е. из оставшейся к этой температуре жидкости одновременно кристаллизуютсякомпоненты А и В:
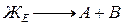
На кривой охлаждения образуется площадка 2-2. Структура сплавапосле охлаждения состоит из зерен компонента А и эвтектики.
По мере охлаждения сплава между точками I и 2 жидкость меняет свою концентрацию по линии AЕ. Чтобы определить состав твердой и жидкой фаз при заданной температуре t1 сплава I (рис.4), необходимо через точку t1 провести коноду, т.е. прямую линию, параллельную оси концентрации, до пересечения с линиями диаграммы и точки пересечения спроектировать на ось концентрации. Точка пересечения l c линией ликвидус покажет концентрацию компонентов А и В в жидкой фазе, точка S - в твердой (чистый компонент А).


Рис. 2.4. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют смесь (эвтектику)



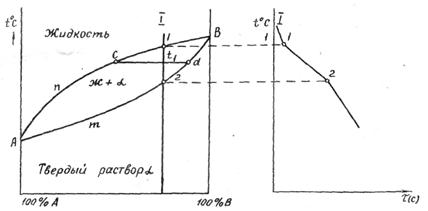
Рис. 2.6. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы друг в друге в жидком и твердом состояниях
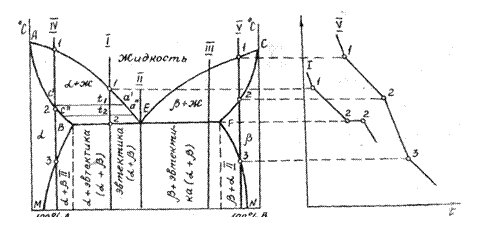

Рис. 2.7. Диаграмма состояния сплавов, компоненты которой
неограниченно растворимы в жидком состоянии, ограниченно в твердом и при кристаллизации образуют смесь (эвтектику)
Соотношение масс фаз при заданной температуре можно определить по правилу отрезков.
| (1) (2) (3) |
Правило отрезков. Массы фаз относятся между собой как обратная пропорция отрезков коноды. Например, при температуре t1 сплав I имеет 2 фазы: жидкую и твердую с количеством масс Qж и Qтв, соотношение фаз определится выражением (I), а количество жидкой и твердой фаз - соотношениями (2) и (3):

где Р - общая масса сплава.
Сплав II - эвтектический. Критическая точка Е - компоненты А и В кристаллизуются одновременно при постоянной температуре:
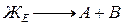
Присутствуют 3 фазы: жидкость эвтектического состава, компоненты А и В. На кривой охлаждения образуется площадка 1-1.
Структура сплава после охлаждения состоит из эвтектики (смеси кристаллов компонентов А и В).
Сплав III - заэвтектический. Критическая точка - 1 начало кристаллизации компонента В. Фазы две: жидкость, кристаллы компонента В. По мере охлаждения сплава жидкость меняет концентрацию по линии ликвидус ЕС. Например, при t2 состав жидкости определится точкой n, спроектированной на ось концентраций, а состав твердой фазы - проекцией точки m.
Критическая точка 2 - кристаллизация эвтектики, т.е. из оставшейся к этой температуре жидкости при постоянной температуре кристаллизуются оба компонента:
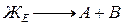
Структура сплава после охлаждения состоит из зерен компонента В и эвтектики.
Правило фаз Гиббса устанавливает зависимость между числами фаз системы, ее компонентов и степеней свободы:
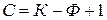 (4)
(4)
где С - число степеней свободы, или вариантность системы;
К - число компонентов системы;
Ф - число фаз, находящихся в равновесии в данной критической точке.
Под числом степеней свободы понимается число независимых параметров системы, которые можно изменить, не изменяя равновесия, например, температуру без изменения числа фаз. Так как степень свободы не может быть меньше нуля и дробным числом, то
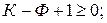
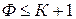 .
.
Следовательно, в двойной системе в равновесии может находиться не более трех фаз, в тройной - не более четырех и т.д.
Например, определим число степеней свободы у сплава I в 1-й критической точке (рис.4):


т.е. с изменением температуры между точками 1-2 число фаз не изменяется, а происходит переход одной фазы (жидкости) в другую (компонент А). Во второй точке

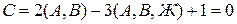
т.е. процесс кристаллизации эвтектики идет при постоянной температуре, система нонвариантна. Изменение температуры ведет к изменению количества фаз.
Диаграмма состояния сплавов, компоненты которой растворимы
в жидком состоянии, нерастворимы в твердом и при кристаллизации
образуют устойчивое химическое соединение (рис.2.5)..
Диаграмма рассматривается как совокупность двух диаграмм состояния, где в роли компонента выступает химическое соединение:
I часть диаграммы - компоненты А и АтВn;
II часть диаграммы - компоненты В и АтВn;
Обе части диаграммы характеризуются неограниченной растворимостью в жидком состоянии. В твердом они нерастворимы, при кристаллизации образуется эвтектическая смесь, состоящая из кристаллов компонента и химического соединения.
'Диаграмма состояний сплавов, компоненты которой неограничен-' но растворимы друг в друге в жидком и твердом состояниях (рис.2.6):
АnВ - ликвидус, начало кристаллизации твердого раствора;
АтВ - солидус, конец кристаллизации твердого раствора.






