—илы ¬ан-ƒер-¬аальса:
ќриентационное взаимодействие осуществл€етс€ между пол€рными молекулами. ƒиполи ориентируютс€ относительно друг друга, прит€гива€сь противоположно зар€женными концами (электростатическое взаимодействие). (≈св.ї 25кƒж/моль).
»ндукционное взаимодействие возникает между пол€рными и непол€рными молекулами. Ёлектрическое поле пол€рной молекулы может индуцировать диполь в непол€рной молекуле (наведенный диполь). ћежду дипол€ми возникает св€зь.
ƒисперсионное взаимодействие осуществл€етс€ между непол€рными молекулами, в которых вследствие пульсирующего движени€ электронного облака возникают мгновенные диполи, взаимодействующие друг с другом.
—илы ¬ан-ƒер-¬аальса завис€т от рассто€ни€ между молекулами. Ќа больших рассто€ни€х (газообразные системы) они ничтожно малы и реально существуют в конденсированных системах (жидкости, газы). ѕри повышении температуры происходит их ослабление вследствие усилени€ теплового движени€ молекул.
¬одородные св€зи (≈св.ї 80кƒж/моль) осуществл€ютс€ между высокопол€рными водородсодержащими молекулами (HF, NH3, H2O) и внутри молекул органических соединений между атомами водорода и наиболее электроотрицательными атомами кислорода, азота. »х можно рассматривать как электростатическое взаимодействие между положительно- и отрицательно- зар€женными част€ми молекул с высокопол€рными св€з€ми. ѕри этом образуютс€ полимерные образовани€ сложной структуры (например, кластеры воды).
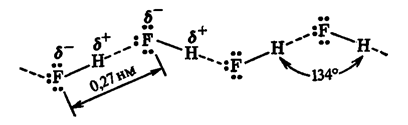 Ќа рис. 21 представлены водородные св€зи между молекулами фтороводорода:
Ќа рис. 21 представлены водородные св€зи между молекулами фтороводорода:
онтрольные вопросы
1. акие типы химической св€зи вы знаете?
2. акими свойствами характеризуетс€ св€зь?
3. ”казать услови€ образовани€ ковалентной и ионной св€зей.
4. ѕользу€сь таблицей величин относительной электроотрицательности, вычислить их разность дл€ св€зей: K-C l, Ca-C l, Fe-C l, Ge-C l. ака€ из них характеризуетс€ наибольшей степенью ковалентности?
5. ”слови€ образовани€ пол€рной и непол€рной св€зей? ѕриведите примеры молекул.
6. ¬ычислите разность относительных электроотрицательностей атомов дл€ св€зей HЦO и OЦAs. ака€ из св€зей более пол€рна? какому классу гидроксидов относитс€ As(OH)3?
7. ќпределить характер св€зей в кристаллических структурах твердых веществ: KF, BaC l 2, сера, йод, карбид кремни€.
8. ќпределить характер св€зей в молекулах SC l 4; SiC l 4; C l F3 и IBr и указать дл€ каждой из них направление смещени€ электронной плотности. –асположить молекулы в р€д в пор€дке увеличени€ пол€рности св€зи.
9. акой параметр используетс€ дл€ количественной оценки пол€рности св€зи в молекуле?
10. ак измен€етс€ длина св€зи в р€ду: N-H; P-H; As-H; Sb-H?
11. „то такое Ђнасыщаемостьї св€зи? аково максимальное насыщение св€зи у элементов 2-го и 3-го периодов и у каких элементов оно реализуетс€?
12. ќхарактеризуйте s и p ковалентные св€зи.
13. „ем характеризуетс€ направленность ковалентной св€зи?
14. акие вы знаете типы гибридизации св€зи, и кака€ им соответствует форма молекул? ѕриведите примеры.
15. акими типами гибридизации атомных орбиталей кремни€ и углерода описываетс€ образование молекул SiH4, C2H4, C2H2 и иона [SiF6]2-?
16. акова пространственна€ структура молекул CO2 и CS2, дипольные моменты которых равны нулю? аким типом гибридизации описываютс€ эти молекулы.
17. ћожно ли предположить, что молекула SO2, обладает линейной структурой, учитыва€ ее пол€рный характер св€зи (m=1,6 ƒ)?
18. ќпределить тип гибридизации электронных облаков атома Ti в молекуле TiF4.
19. ак измен€етс€ валентный угол между св€з€ми:
а) Ќ-Ё-Ќ, где Ё: O, S, Se, Te;
б) Ќ-Ё-Ќ, где Ё: N, P, As, Bi? ќбъ€снить причину такого характера изменени€.
20. ¬ какой из молекул H2S, H2Se или H2Te и почему угол между валентными св€з€ми больше?






