Тема: Узагальнення й систематизація знань з теми «Хімічні реакції»
Мета: узагальнити і систематизувати знання учнів про класифікації хімічних реакцій, кінетику і термодинаміку хімічних реакцій; вдосконалювати вміння писати рівняння хімічних реакцій, вказувати тип реакції за різними ознаками; вдосконалювати вміння розв’язувати тестові завдання, задачі.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, картки із завданнями.
Тип уроку: урок узагальнення й систематизації знань.
Хід уроку
І. Мотивацій навчальної діяльності.
А.Ф. Лосєв якось сказав: «Будь-який труд є осмисленим, результативним та вільним тільки тоді, коли він усвідомлюється як моя особиста … необхідність». Як ви розумієте ці слова? Як ви думаєте, яка мета нашого уроку?
Мета уроку: повторити і узагальнити матеріал з теми «Хімічні реакції», підготуватися до контрольної роботи.
ІІ. Узагальнення й систематизація знань.
Фронтальна бесіда, робота учнів на мультимедійній дошці, самостійна робота в зошиті.
1. За якими ознаками класифікуються хімічні реакції? Заповніть схему на мультимедійній дошці.
2. Які типи реакцій існують за зміною числа реагентів і продуктів реакції, та їх складом? Дайте визначення кожному типу реакцій.
3. Установіть відповідність між рівнянням реакції та ії типом:
А. 2Са + О2 = 2СаО; 1. обміну;
Б. Fe + 2HСl = FeCl2 + H2; 2. сполучення;
В. HNO3 + NaOH = NaNO3 + H2O; 3. розкладу;
Г. 2HgO = 2Hg + O2; 4. заміщення.
4. Як поділяються реакції за зміною ступеня окиснення?
5.Дано схеми двох рівнянь, допишіть рівняння реакцій, вкажіть, яка з них є окисно – відновною, урівняйте рівняння за допомогою електронного балансу, вкажіть окисник і відновник, процеси окиснення та відновлення:
(самостійна робота з наступним обговоренням)
1) КОН + HNO3 →; 2) HCl + Al →.
6. Як класифікуються реакції за тепловим ефектом?
7. В яких одиницях вимірюється тепловий ефект?
8. Вкажіть, які реакції із даних є екзотермічними:
1) S + O2 =SO2 +293 кДж;
2) Fe2O3 + 3H2 = 2Fe + 3H2O ─ 89,6 кДж;
3) 2Н2 + О2 = 2Н2О; ∆Н = ─ 286 кДж;
4) С + Н2О = СО + Н2;; ∆Н = +131,4 кДж.
9. Як поділяються реакції за напрямком протікання (оборотністю)?
10. Які з даних реакцій є оборотними:

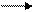 1) N2 + 3H2 2NH3;
1) N2 + 3H2 2NH3;
2) CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl;
3) С + О2 = СО2 + Q;

 4)N2 + O2 2NO.
4)N2 + O2 2NO.
11. Чи з однаковою швидкістю відбуваються хімічні реакції?
12.Від яких чинників залежить швидкість хімічних реакцій?
13. Аналізуючи причини різної швидкості хімічних реакцій, учень дійшов таких висновків:
а) швидкість хімічної реакції зростає з підвищенням температури;
б) швидкість хімічних реакцій прямо пропорційна концентрації реагуючих речовин;
в) з часом швидкість реакції зростає;
г) швидкість реакції можна змінити застосовуючи каталізатор.
В якому пункті учень помилився?
14. Якщо сірку, яка горить в повітрі, внести в посудину з киснем, то швидкість реакції горіння збільшиться внаслідок:
а) збільшення концентрації реагенту;
б) підвищення температури в реакційній суміші;
в) каталітичної дії кисню.
15. «Мозковий штурм» На шматок заліза діємо розчином хлоридної кислоти. Запропонуйте заходи, якими можна прискорити протікання реакції.
 |
16. Порівняйте дію каталізатора і інгібітора на швидкість реакції.
17. Наведені хімічні реакції класифікуйте за всіма вам відомими класифікаційними ознаками:
1) 4NO2 + O2 + 2H2O = 4HNO3 + Q;
 2) С2Н4 + Н2 Nі С2Н6 +Q;
2) С2Н4 + Н2 Nі С2Н6 +Q;
 3) 2Al + Fe2O3 = Al2O3 + 2Fe + Q;
3) 2Al + Fe2O3 = Al2O3 + 2Fe + Q;

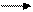 4) СаСО3 СаО + СО2 ─ Q.
4) СаСО3 СаО + СО2 ─ Q.
18. Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення :
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3
Для окисно - відновних реакцій складіть електронний баланс,а для реакцій йонного обміну запишіть рівняння в йонному вигляді.
19. При взаємодії 9, 18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
ІІІ. Підсумки уроку.
ІV. Домашнє завдання
§ 13-18
Підготуватися до контрольної роботи






