Тема: Класифікація хімічних реакцій за різними ознаками.
Мета уроку: узагальнити й систематизувати знання учнів про хімічні реакції, ознайомити із ознаками класифікації хімічних реакцій; розвивати навички і вміння визначати тип хімічних реакцій за рівнянням; навчити розрізняти реакції сполучення, розкладу, заміщення та обміну. Розвивати навички складати рівняння хімічних реакцій, вміння наводити приклади вивчених типів хімічних реакцій.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів.
Тип уроку: комбінований
Хід уроку
І. Мотивація навчальної діяльності учнів.
За два роки знайомства з хімією ми вивчили величезну кількість речовин, познайомилися з їх фізичними і хімічними властивостями, навчилися писати рівняння хімічних реакцій. Пригадайте, що таке хімічна реакція та хімічне рівняння.
Хімічна реакція (хімічне явище) – процес, під час якого одна речовина перетворюється на інші відмінні за складом.
Хімічне рівняння – це зображення хімічної реакції за допомогою хімічних формул та коефіцієнтів.
 Наприклад: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Наприклад: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Вихідні речовини, продукти
реагенти реакції
Що показує хімічне рівняння? (речовини, які вступають в хімічну реакцію і речовин, що утворюються внаслідок реакції)
Відомо дуже багато хімічних реакцій. Всі вони індивідуальні. Але хімічні реакції мають ряд спільних ознак, що дає змогу об’єднати їх у кілька типів. Які типи реакцій ви знаєте з курсу хімії 8 класу?
План:
1. Типи класифікацій хімічних реакцій.
2. Класифікація хімічних реакцій за кількістю і складом реагентів і продуктів реакції:
а) реакції сполучення;
б) реакції розкладу;
в) реакції заміщення;
г) реакції обміну.
ІІ. Вивчення нового матеріалу.
Типи класифікацій хімічних реакцій.
1. Розгляньте таблицю 5 ст. 81 (Хімія 9 кл Н.М. Буринська)
2. Складемо схему класифікації хімічних реакцій
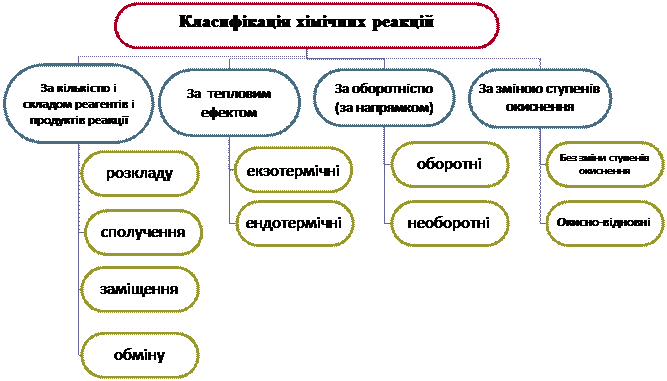
3. Розглянемо на сьогоднішньому уроці першу класифікацію: за кількістю і складом реагентів і продуктів реакції
Класифікація хімічних реакцій за кількістю і складом реагентів і продуктів реакції
1. Реакції сполучення - хімічні реакції, в результаті яких із двох або кількох речовин утворюється одна нова складна речовина.
А +В = АВ
Запропонуйте і запишіть реакції сполучення.
Наприклад:
Zn + S → ZnS
CaO +H2O → Ca(OH)2
2. Реакції розкладу - хімічні реакції, в результаті яких із однієї складної речовини утворюється дві чи більше нових речовин.
АВ → А +В
Запропонуйте і запишіть реакції розкладу.
Наприклад:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Cu(OH)2 → CuO + H2O
3. Реакції заміщення – хімічні реакції між простою і складною речовинами, під час яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.
А +ВС = АС + В
Запропонуйте і запишіть реакції заміщення.
Наприклад:
Zn + 2HCl → ZnCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
4. Реакції обміну - хімічні реакції, під час яких дві речовини обмінюються своїми складовими частинками, утворюючи дві нові речовини.
АВ +СD = АD + CВ
Запропонуйте і запишіть реакції обміну.
Наприклад:
NaOH + HCl → NaCl + H2O
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
ІІІ. Узагальнення й систематизація знань.
1. Як називається реакція, в результаті якої з однієї складної речовини утворюється декілька простіших?
2. Як називається реакція, в результаті якої з декількох речовин утворюється одна зі складнішим складом?
3. Як називається реакція, під час якої дві складні речовини обмінюються своїми складовими частинами?
4. Як називається реакція, у якій атоми простої речовини заміщують атоми одного з елементів у складній?
Установіть відповідність між рівняннями хімічних реакцій та їх типами.
1 K2O + H2O = 2KOH; А обміну;
2 3NaOH + H3PO4 = Na3PO4 + 3H2O; Б заміщення;
3 Fe(OH)2 = FeO + H2O; В сполучення;
4 2Na + 2H2O = 2NaOH + H2. Г розкладу;
Д полімеризації.
Укажіть суму коефіцієнтів у схемі реакції обміну.
Mg + H2O → MgO + H2
FeCl3 + H2SO4 → Fe2(SO4)3 + HCl
Здійснити перетворення. Вказати тип реакції.
Zn → ZnO → ZnCl2→Zn(OH)2 → ZnO
Самостійна робота учнів з перфокартами.
Кожен учень отримає перфокарту і завдання. В перфокарту вкладається чистий аркуш паперу. Учні читають завдання. Відповідь позначають у вигляді хрестика у відповідній комірці.
| А | Б | В | Г | |
| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |
| 
| 
| 
| |
| 
| 
| 
| |

| 
| 
| 
| |
| 
| 
| 
| |
| 
| 
| 
| |
| 
| 
| 
| |

| 
| 
| 
|
І варіант
Позначте в графі
А – реакції сполучення.
Б - реакції розкладу.
В - реакції заміщення.
Г - реакції обміну
1. С + O2→CO2
2. 2Na+2H2O → 2NaOH + H2
3. 2 KMnO4 → K2MnO4+ MnO2 +O2
4. SO3+H2O → H2SO4
5. 2KOH + H2SO4 → K2SO4 + 2H2O
6. BaCl2 + H2SO4 → BaSO4 + 2HCl
7. Fe2O3 + 3H2 → 2Fe + 3H2O
8. 2NaNO3 → 2NaNO2 + O2
9. CuCl2 + Zn → ZnCl2 + Cu
10. 2H2O → 2H2+O2
Здійснити перетворення, вказати тип кожної реакції:
Cu → CuO → CuCl2 →Cu(OH)2 → CuO → Cu.
ІI варіант
Позначте в графі
А – реакції сполучення.
Б - реакції розкладу.
В - реакції заміщення.
Г - реакції обміну
1. 3Fe+ 2O2→Fe3O4
2. Ca+2H2O → Ca(OH)2 + H2
3. 2KClO3 →2 KCl + 3O2
4. 2H2+O2 →2H2O
5. HCl + AgNO3 → HNO3 + AgCl
6. 2Fe2O3 +3Si→ 4Fe + 3SiO2
7. K2O + H2SO4 → K2SO4 + H2O
8. 2Cu(NO3)2 →2CuO + 4NO2 + O2
9. FeCl2 + Mg → MgCl2 + Fe
10. 4NO2 + 2H2O + O2→ 4HNO3
Здійснити перетворення, вказати тип кожної реакції:
Р → Р2О5 → Н3РО4 → Na3PO4 → Ca3(PO4)2
ІV. Підсумки уроку.
V. Домашнє завдання
§13 Хімія 9 кл Н.М. Буринська
Впр. 2 с. 84 (всім обов’язково)






