Фосфор в природе в свободном виде не встречается, но по своей важно-
сти ничуть не уступает азоту. На его долю приходится 0,08 % массы зем-
ной коры. Основные минералы фосфора: фосфорит Са3(РО4)2 и аппатит
3Са3(РО4)2. СаF2.
Фосфор – образует три аллотропических модификации:
белый, красный, черный. Белый фосфор (Рбел.) имеет молекулярную решет-
ку. При объединении 4-х атомов фосфора в молекулу угол между р-орбита-
лями уменьшается от 90о до 60 о и имеют форму правильной трехгранной пирамиды, а каждый атом фосфора находится в одной из вершин пирамиды и связан тремя сигма -связями с другими тремя атомами. Поэтому молекулы Р4 можно сравнить со сжатой пружиной. Возможно, этим и объясняется высокая реакционная способность белого фосфора. В кристаллической решетке молекулы белого фосфора связаны межмолекулярными силами (силы Ван-дер-Ваальса), а так как они очень слабы, то Рбел. Очень легко распадается на молекулы под влиянием температуры, растворителя и т.д.В воде Рбел. плохо растворим, но хорошо растворяется в органических растворителях. Ядовит (0,15 г – смертельная доза)
Как все вещества с молекулярной решеткой, белый фосфор легко плавится и летуч.
В отличие от белого фосфора красный и черный фосфоры имеют атомную кристаллическую решетку. Поэтому они нерастворимы почти во всех растворителях, не летучи и, как уже отмечалось, не ядовиты.
Рбел. → Ркр.
(при нагревании 250-300 оС, под давлением и без доступа воздуха)
Ркр. – темно-красное мелкокристаллическое малоле-
тучее вещество. Ркр.- нерастворим в органических растворителях, почти не ядовит и менее опасен.
Самовоспламенение фосфора красного не происходит, однако зажечь его
довольно легко, горение протекает очень бурно. С окислителями образует
сильно взрывчатые смеси. Ркр. – высокополимерное вещество, угол между
связями – 90о
Наиболее устойчивой формой фосфора является черный фосфор – Рчер.
Получают его из белого фосфора нагреванием при 200 о С и очень высокомдавлении. Рчер. – полимер, угол между связями равен 99о
По внешнемувиду и свойствам напоминает графит, жирен на ощупь, легко разделяется на чешуйки. Полупроводник. При комнатной температуре ни в чем не растворяется. Химически малоактивен. Не ядовит.
Химические свойства фосфора.
Белый фосфор сгорает в атмосфере кислорода с образованием Р2О3 (недостаток О2) или Р2О5 (избыток О2):
4 Р + 5 О2 = 2 Р2О5
С водородом фосфор не взаимодействует.
Фосфор легко реагирует с гало-
генами и серой, образуя два ряда соединений (в степени окисления +3 или
+5):
4 Р + 10 С12 = 4 РС15
2 Р + 3 S = Р2S3
По отношению к металлам фосфор проявляет окислительные свойства и
образует фосфиды:
К + Р = К3Р
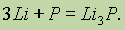
Фосфиды активных металлов солеподобные вещества, разлагающиеся во-
дой:
К3Р + 3 Н2О = РН3 ↑ + 3 КОН
Концентрированной азотной и серной кислотами фосфор окисляется с
образованием фосфорной кислоты:
3 Р + 5 НNO3 (конц.) + 2 Н2О → 3 Н3РО4 + 5 NO
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
В щелочах при нагревании фосфор диспропорционирует:
4 Р + 3 NaOН + 3 Н2О → Р-3Н3↑+ 3 NаН2Р+1О2
8Р + 12Н2О = 5РН3 + 3Н3РО4(диспропорционирует)
2P + 8H2O →t 2H3PO4 + 5H2↑;
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 → 5KCl + 3P2O5
Получают фосфор восстановлением фосфоритов или аппатитов:
Са3(РО4)2 + 3 SiO2 t>1000→3 CaSiO3 + P2O5
(менее летучий оксид вытесняет более летучий)
P2O5 + 5 C = 2 P + 5 CO или
Са3(РО4)2 + 3 SiO2 + 5 C = 3 CaSiO3 + 2 P + 5 CO
Соединения фосфора. В соединениях фосфор проявляет степени окис-
ления от –3 до +5. Наиболее устойчивой для фосфора является степень
окисления +5.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН3 – стибин; BiН3 – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических
Действием на нитриды и фосфиды арсениды, антимониды и висмутиды, например Mg3 As2, Mg3 Sb2 и Mg3 Bi2. разбавленных кислот могут быть получены аналогичные аммиаку и фосфину мышьяковистый («арсин»), сурьмянистый («стибин») и висмутистый («висмутин») водороды общей формулы ЭН3. Реакции идут по схеме:
Mg3 Э2 + 6HCl = 3MgCl2 + 2ЭH3
Так как соединения эти малоустойчивы, больший или меньший распад их на элементы имеет место уже в момент образования и поэтому практически они всегда выделяются в смеси с водородом. Особенно это относится к BiH3, который из–за своей чрезвычайной неустойчивости до сих пор почти не изучен.
Арсин и стибин представляют собой бесцветные, очень ядовитые газы с чесночным (AsH3) или похожим на сероводородный (SbH3) запахом. Их точки плавления и кипения сопоставлены ниже с соответствующими данными для аммиака и фосфина:
Восстановительная активность гидридов в ряду NH3 – РН3 – AsH3 –SbH3 последовательно возрастает. Столь характерные для аммиака реакции присоединения вовсе не наблюдаются у арсина и стибина. Оба они довольно хорошо растворимы в воде, но химически с ней не взаимодействуют. При нагревании AsH3 и SbH3 легко разлагаются на элементы, а будучи подожжены на воздухе, сгорают с образованием воды и соответствующих окисей.
Помимо разложения арсенидов и антимонидов кислотами, арсин и стибин могут быть получены также действием водорода в момент выделения на самые разнообразные растворимые соединения мышьяка и сурьмы, например по реакции
As2 O3 + 6Zn+12HCl = 6ZnCl2 + 2AsH3 + 3H2 O
На такой реакции, в сочетании с термическим разложением АsН3, основан один из методов открытия мышьяка.
Фосфин РН3 – бесцветный газ с запахом гнилой рыбы, очень ядовит,
плохо растворим в воде. Молекула РН3 имеет форму тригональной пира-
миды, с углом равным 93,5о. Фосфин в отличие от аммиака нельзя полу-
чить непосредственным взаимодействием фосфора с водородом. Его полу-
чают либо из фосфидов активных металлов, либо при взаимодействии бе-
лого фосфора со щелочами:
Р + Na = Na3Р фосфид натрия
Na3Р + 3 НС1 = 3 NaС1 + РН3↑
Na3Р + 3 Н2О = 3 NaОН + РН3↑
Основные свойства РН3 выражены слабее по сравнению с аммиаком.
Фосфин плохо растворим в воде (его водные растворы имеют рН около 7).
Практически не взаимодействуют с кислотами. Только с наиболее сильны-
ми кислотами образует соли фосфония, значительно менее прочные по
сравнению с солями аммония:
НI (г)+ РН3 (г) = РН4I (к) (Иодид фосфония)
РН4I – малоустойчивое бесцветное кристаллическое вещество, легко
разлагается водой.
Фосфин самовоспламеняется на воздухе:
2 РН3 + 4 О2 = P2O5 + 3 Н2О
РН3 – сильный восстановитель в щелочной среде, окисляется до фосфора
или солей фосфористой кислоты:
РН3 + 3 ОН – 3 ē = Р + 3 Н2О; (φ˚ = -0,89 В)






