Митохондрия, окруженная двойной мембраной, имеет две полости и четыре мембранные поверхности. Наружная мембрана содержит значительное количество белка, порина. Этот белок формирует поры с диаметром, позволяющим молекулам размером до 5000 дальтон свободно проходить в первую полость. Таким образом, ионы, аминокислоты, сахара и другие цитозольные компоненты беспрепятственно проходят в первое, межмембранное пространство. Группа ферментов, локализованная в этом пространстве, фосфорилирует нуклеотиды и сахара нуклеотидов.
Внутренняя мембрана митохондрий формирует гораздо более плотный барьер, она значительно больше наружной мембраны и образует множество смежных складок - крист. Эти складки значительно увеличивают площадь поверхности митохондрий. Многие ферментативные реакции происходят более эффективно, если ферменты связаны с митохондриальной поверхностью, что и обеспечивают кристы (см. рис. 5-1).

Митохондриальный матрикс
Митохондриальный матрикс играет важную роль. Матриксная поверхность внутренней мембраны включает в себя белковые комплексы, участвующие в синтезе АТФ. Огромное количество метаболических ферментов располагается в митохондриальном матриксе, включая ферменты, участвующие в окислении липидов, окислении углеводов, в цикле трикарбоновых кислот, или цикле Кребса. Кроме них, в матриксе локализуются митохондриальный геном, а также рибосомы, тРНК ферменты, необходимые для транскрипции митохондриальной ДНК и экспрессии соответствующих генов. Число этих генов относительно мало, по сравнению с генами, расположенными в ядре.
Механизм транспорта
Митохондриальных белков
Митохондрии служат метаболическим центром клетки; эти органеллы - место синтеза АТФ, процесса, требующего участия многочисленных ферментов, большинство из которых поступает из цитозоля (рис. 3-8).

Почти все белки, предназначенные для транспорта в митохондрии, синтезируются на полирибосомах, локализованных в цитозоле.
Белки, предназначенные для транспорта в митохондрии, имеют сигнальный пептид, локализованный на N-конце. Сигнальные пептиды варьируют в размере от 12 до 80 остатков. Этот участок белка также формирует амфифильный завиток: заряженные остатки сгруппированы на одной стороне альфа-спирали, а неполярные остатки локализованы на другой стороне. Амфифильный завиток соединяется с участком связывания митохондриального распознающего рецептора, локализованного на наружной мембране.
Процесс транспорта достаточно сложен и включает несколько элементов (табл. 3-4).
Таблица 3-4. Основные элементы системы транспорта белка в митохондрию
| Элементы | Роль |
| Рибосомы | Почти все импортируемые белки производятся на полирибосомах в цитозоле |
| Сигнальный пептид | Белки, предназначенные для мтохондрий, имеют сигнальные пептиды, локализованные на N-конце |
| Амфифильный завиток | Сигнальные пептиды формируют амфифильный завиток. Заряженные остатки сгруппированы на одной стороне завитка, а неполярные остатки локализованы на другой стороне |
| Митохондриальный распознающий рецептор | Амфифильный завиток взаимодействует со связывающим доменом митохондриального рецептора распознавания, локализованного на наружноймембране |
| Шапероны | Вновь синтезированные для митохондрий белковые цепи связаны с шаперонными белками, которые способствуют определению правильной укладки и функционирования импортированных белков |
Митохондриальные шапероны
Вновь синтезированные белки, предназначенные для митохондрий, при подготовке к импорту связываются с другим классом цитозольных белков. Существует несколько типов этих белков, называемых шаперонами. Они обнаруживаются почти во всех клеточных органеллах и в цитоплазме. Кроме других функций, шапероны обеспечивают правильное сворачивание (фолдинг) и окончательную конформацию других белков, и поэтому необходимы для здоровья клетки и организма.
Шапероны найдены во всех организмах от бактерий до млекопитающих. В некоторых случаях эти белки имеют другое название. Одно из семейств шаперонов называется белками теплового шока (hsp) (рис. 3-9).
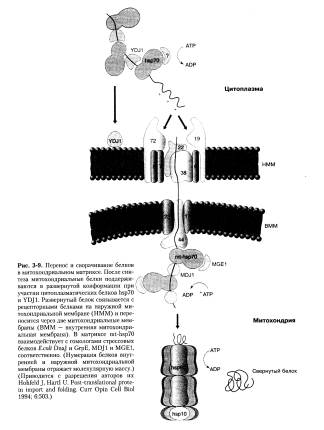
Их обнаружили случайно: исследователи открыли, что определенные белки синтезируются в клетках плодовой мушки при увеличении температуры всего на несколько градусов. Белки теплового шока имеют большую внутривидовую устойчивость и интенсивно экспрессируются во всех клетках даже в нормальных для роста условиях. Их транскрипция и трансляция значительно возрастают при чрезвычайных условиях внешней среды. Предполагают, что шапероны необходимы для правильного сворачивания белков в условиях теплового стресса.






