| 36 |
Используя метод электронного баланса, составьте уравнение реакции:
K2MnO4 + …  MnBr2 + Br2 + … + H2O
MnBr2 + Br2 + … + H2O
Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | ||
Элементы ответа:
1) Составлен электронный баланс:
| |||
| 2) Указано, что бромоводород (за счёт брома в степени окисления –1) является восстановителем, а манганат калия (за счёт марганца в степени окисления +6) – окислителем. | |||
| 3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции: K2MnO4 + 8HBr = MnBr2 + 2Br2 + 4H2O + 2KBr | |||
| Ответ правильный и полный, содержит все названные выше элементы | |||
| Правильно записаны только два из названных выше элементов ответа | |||
| Правильно записан один из названных выше элементов ответа | |||
| Все элементы ответа записаны неверно | |||
| Максимальный балл | 3 |
| 37 |
Железную окалину растворили в концентрированной азотной кислоте.
К полученному раствору добавили раствор гидроксида натрия. Выделившийся осадок отделили и прокалили. Образовавшийся твёрдый остаток сплавили с железом.
Напишите уравнения четырёх описанных реакций.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: написаны четыре уравнения описанных реакций: 1) Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2О 2) Fe(NO3)3 + 3NaOH = 3NaNO3 + Fe(OH)3↓ 3) 2Fe(OH)3 = Fe2O3 + 3H2O (при нагревании) 4) Fe2O3 + Fe = 3FeO (при нагревании) | |
| Правильно записаны четыре уравнения реакций | |
| Правильно записаны три уравнения реакций | |
| Правильно записаны два уравнения реакций | |
| Правильно записано одно уравнение реакции | |
| Все уравнения реакций записаны неверно | |
| Максимальный балл | 4 |
| 38 |
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Ответ включает в себя пять уравнений реакций, соответствующих схеме превращений:
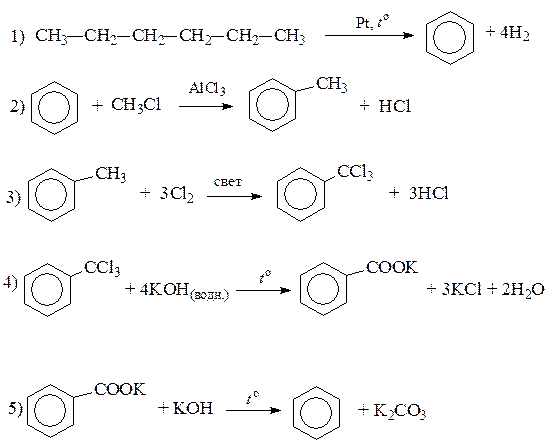
| 1. |
| Правильно записаны пять уравнений реакций | |
| Правильно записаны четыре уравнения реакций | |
| Правильно записаны три уравнения реакций | |
| Правильно записаны два уравнения реакций | |
| Правильно записано одно уравнение реакции | |
| Все уравнения реакций записаны неверно | |
| Максимальный балл | 5 |
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
| 39 |
Хлорид фосфора(V) массой 4,17 г полностью прореагировал с водой. Какой объём раствора гидроксида калия с массовой долей 10% (плотностью 1,07 г/мл) необходим для полной нейтрализации полученного раствора?
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) Записаны уравнения реакций гидролиза хлорида фосфора и нейтрализации двух кислот: PCl5 + 4H2O = H3PO4 + 5HCl H3PO4 + 3KOH = K3PO4 + 3H2O HCl + KOH = KCl + H2O 2) Рассчитаны количество вещества хлорида фосфора(V) и кислот, образовавшихся при гидролизе: n(PCl5) = 4,17 / 208,5 = 0,02 моль n(H3PO4) = n(PCl5) = 0,02 моль n(HCl) = 5n(PCl5) = 0,1 моль 3) Рассчитаны необходимые количество вещества и масса щёлочи: n(KOH) = n(HCl) + 3n(H3PO4) = 0,1 + 0,06 = 0,16 моль m(KOH) = 0,16 ∙ 56 = 8,96 г 4) Рассчитаны масса и объём раствора щёлочи: m(p-pa)(KOH) = m(KOH) / w(KOH) = 8,96 / 0,10 = 89,6 г V(p-pa)(KOH) = m(p-pa)(KOH) / ρ = 89,6 / 1,07 = 83,7 мл | |
| Ответ правильный и полный, включает все названные выше элементы | |
| В ответе допущена ошибка в одном из названных выше элементов | |
| В ответе допущены ошибки в двух из названных выше элементов | |
| В ответе допущены ошибки в трёх из названных выше элементов | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
Примечание. В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
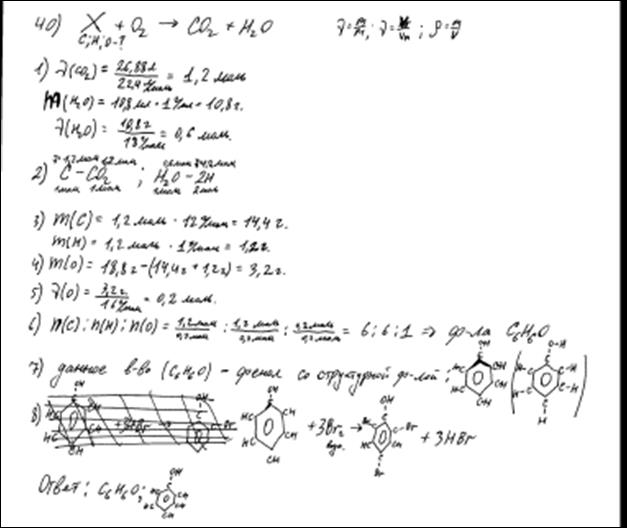
| 40 |
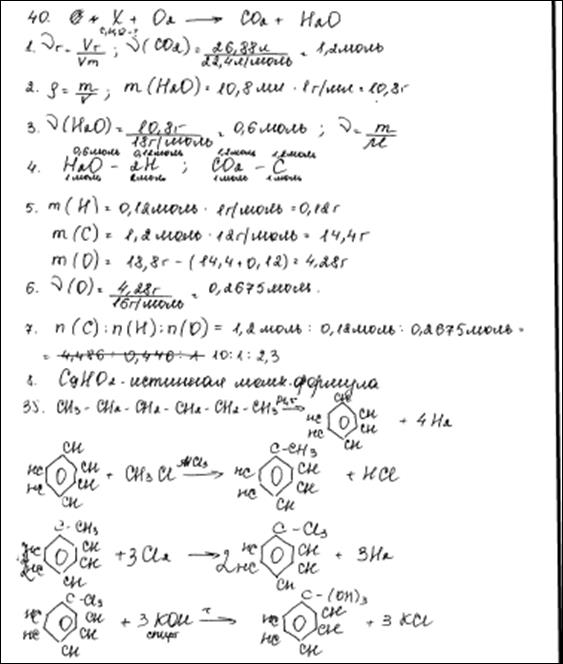
При сгорании 18,8 г органического вещества получили 26,88 л (н.у.) углекислого газа и 10,8 мл воды. Известно, что это вещество реагирует как
с гидроксидом натрия, так и с бромной водой.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции данного вещества с бромной водой.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа:
Общая формула вещества – CxHyOz
1) Найдены количество вещества углекислого газа и воды:
n(CO2) = 26,88 / 22,4 = 1,2 моль
n(H2O) = 10,8 / 18 = 0,6 моль
2) Определена молекулярная формула вещества:
n(C) = n(CO2) = 1,2 моль
m(C) = 1,2 · 12 = 14,4 г
n(H) = 2n(H2O) = 1,2 моль
m(H) = 1,2 г
m(O) = 18,8 – 14,4 – 1,2 = 3,2 г
n(O) = 3,2 / 16 = 0,2 моль
x: y: z = 1,2: 1,2: 0,2 = 6: 6: 1
Молекулярная формула – С6Н6O
3) Составлена структурная формула вещества:
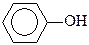 4) Составлено уравнение реакции данного вещества с бромной водой:
4) Составлено уравнение реакции данного вещества с бромной водой:

| |
| Ответ правильный и полный, содержит все названные выше элементы | |
| В ответе допущена ошибка в одном элементе ответа | |
| В ответе допущена ошибка в двух элементах ответа | |
| В ответе допущена ошибка в трёх элементах ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
Работа 1



Работа 2

Работа 3

Работа 4









