Мольная доля вещества в растворе определяется отношением количества этого вещества к общему количеству вещества в растворе:
 ,
,
 , (6.6)
, (6.6)
где N 1 – мольная доля растворенного вещества; N 2 – мольная доля растворителя в растворе.
При условии, что раствор состоит из растворителя и одного растворенного вещества, справедливо равенство
N 1 + N 2 = 1. (6.7)
Пример 5. Рассчитать мольные доли глюкозы С6H12O6 и воды в растворе с массовой долей глюкозы 36 %.
Решение. Пусть масса раствора m = 100 г. Тогда масса глюкозы в растворе m 1 = 36 г, масса воды m 2 = 64 г. Определим молярные массы глюкозы и воды:


Определим количество глюкозы и воды в растворе:

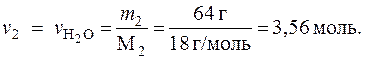
Определим мольную долю растворенного вещества – глюкозы:

Определим мольную долю растворителя – воды:

6.1.6. Титр раствора (Т)
Титр раствора определяет массу растворенного вещества в граммах (г), которая содержится в 1 мл раствора. Титр раствора, г/мл, можно рассчитать по уравнению
 . (6.8)
. (6.8)
Пример 6. Определить титр раствора KOH, эквивалентная концентрация которого С н = 0,01 н., (моль/л).
Решение. Относительный эквивалент KOH – Э1 = 1. Определим молярную массу KOH:
М1 = (1×39 + 1×16 + 1×1) г/моль = 56 г/моль.
По уравнению (6.8) рассчитаем титр раствора:
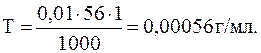
Вычисления, связанные с пересчетом концентраций
Растворов из одних единиц в другие
Пример 7. Массовая доля CuSO4 в водном растворе составляет 10 %. Плотность раствора 1,107 г/см3. Вычислить молярную, эквивалентную, моляльную концентрацию и мольную долю сульфата меди.
Решение. Молярная масса растворителя (воды) М2 = 18 г/моль. Относительный эквивалент CuSO4 – Э1 = 1/2. Рассчитаем молярную и эквивалентную массу сульфата меди:
М1 = (64 + 32 + 4×16) г/моль = 160 г/моль;
m э(1) = 1/2×160 г/моль = 80 г/моль.
Пусть объем раствора V = 1 л, рассчитаем массу раствора:
m = V ×r = 1000 мл × 1,107 г/мл = 1107 г.
Определим массу CuSO4 в одном литре раствора:
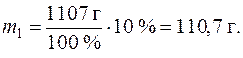
Определим массу растворителя (воды) в растворе:
m 2 = m - m 1 = 1107 г - 110,7 г = 996,3 г.
Определим количество растворенного вещества (CuSO4) и растворителя (H2O) в растворе:

Рассчитаем молярную, эквивалентную, моляльную концентрации и мольную долю растворенного вещества:


 моль/кг растворителя,
моль/кг растворителя,

Приготовление разбавленных растворов
Из концентрированных
Разбавлением называется уменьшение концентрации раствора в результате добавления растворителя. Разбавление сопровождается увеличением объема раствора и общей массы раствора. Количество и масса растворенного вещества не изменяются при разбавлении.
Введем обозначения: mx – масса растворителя, добавленного в исходный раствор, г; Vx – объем растворителя, добавленного в исходный раствор, дм3; n x – количество растворителя, добавленного в исходный раствор, моль.
Тогда концентрации разбавленного раствора: С *, С *М, С *н, С * m, N* (1) можно рассчитать на основании следующих уравнений:
 ; (6.9)
; (6.9)
 ; (6.10)
; (6.10)
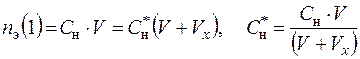 ; (6.11)
; (6.11)
 ; (6.12)
; (6.12)
 , (6.13)
, (6.13)
где С, С М, С н, Сm – процентная, молярная, эквивалентная, моляльная концентрации в исходном растворе.
Пример 8. Какой объем раствора ортофосфорной кислоты с массовой долей H3PO4 36 % (r = 1,219 г/см3) требуется для приготовления 13 л 0,15 н. раствора H3PO4?
Решение. Проведем анализ условия задачи и введем обозначения: раствор № 2 получен в результате разбавления раствора № 1. Объем раствора № 2 V * = 13 л, эквивалентная концентрация этого раствора С *н = 0,15 н. Определим количество эквивалентов растворенного вещества и учтем, что при разбавлении количество растворенного вещества в растворе не изменяется. Тогда в соответствии с уравнением (6.11)

где С н и V – соответственно эквивалентная концентрация и объем раствора № 1. Однако по условию задачи дана массовая доля (С) раствора № 1, поэтому необходимо перейти от массовой доли исходного раствора к его эквивалентной концентрации (см. пример 7): в 100 г исходного раствора содержится 36 г H3PO4 и 64 г H2O; молярная масса и относительный эквивалент H3PO4 соответственно М1 = 98 г/моль; Э1 = 1/3. Рассчитаем эквивалентную концентрацию исходного раствора по уравнению (6.3):

Определим объем раствора 1, который использовали для приготовления 13 л раствора 2:







