Химические реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми. Реакций этого типа очень мало, большинство реакций являются обратимыми. В обратимых реакциях образовавшиеся вещества взаимодействуют между собой, превращаясь в исходные, т. е. такие реакции могут протекать как в прямом, так и в обратном направлении. В уравнениях обратимых реакций вместо знака = используется знак «.
Рассмотрим гомогенную обратимую реакцию
A + B «C + D. (5.1)
Реакция, направленная слева направо, называется прямой, а противоположная – обратной. Согласно закону действия масс скорость прямой реакции определяется выражением
v пр = k пр × CA × CB, (5.2)
а скорость обратной реакции – выражением
v обр = k обр × CC × CD. (5.3)
В начальный момент времени t скорость прямой реакции максимальна, со временем она уменьшается, так как расходуются исходные вещества А и В. Напротив, скорость обратной реакции со временем возрастает, так как накапливаются вещества С и D (рис. 3). Через некоторое время tравн скорости прямой и обратной реакции будут равны друг другу.
v пр = v обр. (5.4)
Такое состояние называется динамическим химическим равновесием. В состоянии химического равновесия прямая и обратная реакции не прекращаются, однако химический состав системы сохраняется постоянным. Например, за некоторый промежуток времени в системе (5.1) по прямой реакции образуется х моль вещества С. За этот же промежуток времени в обратной реакции расходуется также х моль вещества С, аналогично и для веществ А, В и D данной системы. Следовательно, в состоянии равновесия концентрация каждого вещества остается во времени постоянной и называется равновесной. Равновесные концентрации обозначаются формулами веществ, заключенными в квадратные скобки, например, [ A ], [ B ], [ C ], [ D ], тогда как неравновесные концентрации обозначают CA, CB, CC, CD.

Рис. 3. Состояние химического равновесия
Подставив в уравнение (5.4) выражения для скорости прямой (5.2) и обратной (5.3) реакций с учетом равновесных концентраций, получим
k пр ×[ A ][ B ] = k обр×[ C ][ D ], (5.5)
откуда
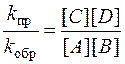 . (5.6)
. (5.6)
Отношение констант скоростей k пр/ k обр при данной температуре также является постоянной величиной, называемой константой равновесия К р.
 (5.7)
(5.7)
Тогда окончательно получаем
 . (5.8)
. (5.8)
Чем больше значение константы равновесия, тем «глубже» протекает прямая реакция до момента установления в системе химического равновесия.
Для реакции общего вида
aA + bB «cC + dD (5.9)
выражение константы равновесия имеет вид
 . (5.10)
. (5.10)
В случае гетерогенной реакции концентрации твердых веществ в выражение К р не входят, так как они, как правило, остаются постоянными.
Пример 1. Написать выражение константы равновесия для следующих реакций: а) 2SO2 + O2 «2SO3; б) 3Fe + 4H2O(г) «Fe3O4 + 4H2.
Решение. Вещества SO2, O2 и SO3 – газы, следовательно, реакция 2SO2 + O2 «2SO3 – гомогенная:
 .
.
Реакция 3Fe + 4H2O(г) «Fe3O4 + 4H2 является гетерогенной, концентрации твердых веществ Fe и Fe3O4 в выражение константы равновесия не входят:
 .
.
Пример 2. В гомогенной системе 4HCl(г) + O2 «2H2O(г) + 2Cl2 равновесие установилось при концентрации Cl2, равной 0,14 моль/л. Исходные концентрации HCl и O2 составляли соответственно 0,48 и 0,39 моль/л. Вычислить константу равновесия.
Решение. Из уравнения реакции видно, что на образование 0,14 моль Cl2 расходуется 2 × 0,14 = 0,28 моль HCl и 0,5 × 0,14 = 0,07 моль O2. Следовательно, к моменту равновесия осталось (0,48 - 0,28) = 0,20 моль HCl и (0,39 - 0,07) = 0,32 моль O2. Равновесная концентрация H2O равна равновесной концентрации Cl2. Эти расчеты удобно представить в виде таблицы:
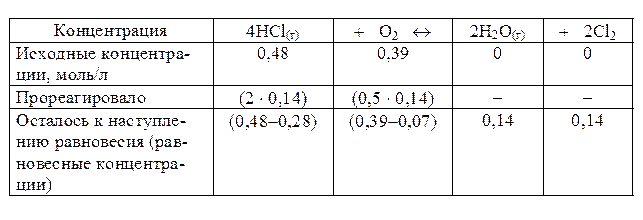
Рассчитаем константу равновесия:
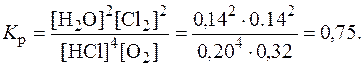
Пример 3. Константа равновесия гомогенной системы H2 + I2 «2HI при некоторой температуре равна 36. Определить, какой процент водорода и йода перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0,01 моль/л.
Решение. Пусть к моменту равновесия прореагировало х моль H2. Выразим равновесные концентрации веществ через исходные в виде таблицы:

Подставим значения равновесных концентраций в выражение константы равновесия:

Извлекая из обеих частей уравнения корень, получим
2 х /(0,01- х) = 6, откуда х = 0,0075.
Таким образом, из 0,01 моль водорода и 0,01 моль йода прореагировало по 0,0075 моль, что составляет 75 %.
Значение константы равновесия зависит только от природы участвующих в реакции веществ и температуры. Если в системе присутствует катализатор, то он в равной степени изменяет скорости и прямой, и обратной реакции, ускоряет достижение химического равновесия, но не изменяет значения К р.
Существует связь между константой равновесия и энергией Гиббса. Чем более отрицательно значение D G °, тем сильнее сдвинуто равновесие в сторону продуктов реакции, т. е. тем больше константа равновесия. При температуре Т связь между К р и D G выражается уравнением
D G ° = - RT ln K p. (5.11)






