Оксид RO является для большинства халькогенов неустойчивым оксидом и в момент образования превращается в RO2. Так, выделенный SO уже при обычных условиях быстро распадается:
2SO → SO2 + S.
Оксиды RO2 и RO3 являются кислотными оксидами, которым соответствуют кислоты общего вида H2RO3 и H2RO4. Сила этих кислот в подгруппе сверху вниз закономерно уменьшается, что объясняется увеличением в аналогичном направлении металлических свойств у элементов и, как следствие этого, возрастанием основности их кислородсодержащих соединений. Причем для каждого элемента кислота H2RO4 является более сильной, чем кислота H2RO3, так как в первом случае халькогены имеют большую степень окисления (+ 6), чем во втором (+ 4).
Таблица 5. Некоторые физические свойства атомов элементов VI А группы и образуемых ими наиболее устойчивых аллотропных
модификаций
| Символ элемента | O | S | Se | Te |
| Радиус атома, нм | 0,066 | 0,104 | 0,117 | 0,137 |
| Энергия ионизации атома, кДж/моль | ||||
| Энергия сродства к электрону, кДж/моль | ||||
| Относительная электроотрицательность | 3,5 | 2,6 | 2,5 | 2,1 |
| Плотность г/см3 простого вещества | 0,0014 | 2,06 | 4,82 | 6,25 |
| Агрегатное состояние простого вещества при н.у. | газ | тв. тело | тв. тело | тв. тело |
| Температура плавления простого вещества, оС | -218,9 | 119,3 |
Как следует из таблиц 4 и 5, величины энергии ионизации, энергии сродства к электрону, электроотрицательности у элементов VI А группы меньше, чем у галогенов, но, как и для галогенов, значения этих величин в группе сверху вниз уменьшаются, что свидетельствует об ослаблении неметаллических свойств элементов и их простых веществ (а, значит, и их окислительной и реакционной способности) при переходе от кислорода к теллуру.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ
V A ГРУППЫ
Нахождение в природе
В V A группу входят следующие элементы: азот N, фосфор Р, мышьяк (As), сурьма (Sb) и висмут (Bi).
Все они носят общее название пниктогены (образовано от символов химических элементов фосфора Р и азота N) и принадлежат к р-элементам.
В природе пниктогены встречаются, главным образом, в связанном виде, т.е. входят в состав различных соединений. Исключение составляют азот и висмут.
В виде простого вещества N2 азот образует большую часть атмосферы (≈ 78% по объему), а висмут в небольших количествах встречается в самородном состоянии.
Из элементов V A группы больше всего распространен на Земле фосфор. Содержание его в земной коре составляет ≈ 0,08% по массе. За ним следует азот (≈ 0,04% по массе), который по распространенности занимает ≈ 20 место среди всех элементов. Мышьяк, сурьма и висмут встречаются в природе гораздо реже. Их массовая доля в земной коре составляет, соответственно,
5 ∙ 10-4%, 4 ∙ 10-5% и 2 ∙ 10-5%.
Азот и сурьма состоят их двух устойчивых изотопов, а фосфор, висмут и мышьяк – только из одного.
Строение атомов, физические и химические свойства пниктогенов
Пниктогены в целом характеризуются как неметаллы, однако только для N, P и As неметаллические свойства являются преобладающими. Для сурьмы, и в особенности для висмута, металлические свойства выражены сильнее, чем неметаллические. В связи с этим Sb и Bi часто относят к металлам. Но, в отличие от типичных металлов, сурьма и висмут не обладают ковкостью, пластичностью, а, наоборот, являются хрупкими веществами, гораздо хуже проводят электрический ток. Например, удельная электропроводность висмута при 18оС почти в 100 раз меньше, чем у серебра.
Некоторые физические свойства атомов пниктогенов и образуемых ими простых веществ представлены в таблице 6.
Таблица 4. Некоторые физические свойства атомов элементов VA группы и образуемых ими наиболее устойчивых аллотропных модификаций
| Символ элемента | N | P | As | Sb | Bi |
| Радиус атома, нм | 0,052 | 0,092 | 0,1 | 0,119 | 0,13 |
| Энергия ионизации атома, кДж/моль | |||||
| Относительная электроотрицательность | 3,07 | 2,1 | 2,2 | 1,82 | 1,67 |
| Агрегатное состояние,образуемого простого вещества (при н.у.) | газ | тв. тело | тв. тело | тв. тело | тв. тело |
| Плотность простого вещества (н.у.) г/см3 | 0,00125 | 2,2 | 5,7 | 6,68 | 9,8 |
| Температура плавления простого вещества, оС | -210 | ~1000 (для черного фосфора | ~630 |
 На внешнем энергетическом уровне атомы элементов V A группы имеют по 5 электронов.
На внешнем энергетическом уровне атомы элементов V A группы имеют по 5 электронов.
|
Азот отличается от всех остальных элементов группы тем, что у него на внешнем слое отсутствует d-подуровень.
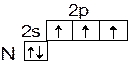
В невозбужденном состоянии все элементы V A группы имеют на внешнем слое 3 неспаренных электрона. Значит, они могут образовать по обменному механизму три ковалентные связи с другими атомами и их валентность в этом случае будет равна трем. В возбужденном состоянии количество неспаренных электронов может увеличиваться до 5 за счет распаривания электронной пары:

Соответственно и валентность в этом случае тоже будет равна 5.
У азота электронная пара не может распариться, поэтому его атомы в соединениях образуют только 3 ковалентные связи по обменному механизму. Однако в ряде веществ (NH4Cl, HNO3 и т.д.) валентность азота может быть равна 4. Дополнительная четвертая связь в этом случае возникает по донорно-акцепторному механизму, причем атомы N выступают в роли донора электронной пары.






