22. Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||||
| А) | соединения | 1) | 2СН4 → С2Н2 + 3Н2 | ||
| Б) | разложения | 2) | 2SO2 + O2 = 2SO3 | ||
| В) | замещения | 3) | СН4 + Cl2 → СН3Cl + HCl | ||
| Г) | обмена | 4) | AgNO3 + KCl = AgCl↓ + KNO3 | ||
| А | Б | В | Г | ||
23. Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||||
| А) | соединения, эндотермическая | 1) | Cu(OH)2 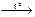 CuO + H2O CuO + H2O
| ||
| Б) | соединения, экзотермическая | 2) | CaO + H2O = Ca(OH)2 | ||
| В) | разложения, эндотермическая | 3) | N2 + O2  2NO 2NO
| ||
| Г) | обмена, экзотермическая | 4) | 2K + 2H2O = 2KOH + H2 | ||
| 5) | HCl + NaOH = NaCl + H2O | ||||
| А | Б | В | Г | ||
Тепловой эффект химической реакции
Базовый уровень сложности
1. В результате реакции, термохимическое уравнение которой
2Mg + O2 = 2MgO + 1200 кДж,
выделилось 600 кДж теплоты. Объем (н.у.) вступившего при этом в реакцию кислорода равен
| 1) | 44,8 л | 2) | 22,4 л | 3) | 11,2 л | 4) | 112 л |
2. В результате реакции, термохимическое уравнение которой
2Сa + O2 = 2CaO + 1270 кДж,
образовалось 56 г оксида кальция. Количество выделившейся при этом теплоты равно
| 1) | 635 кДж | 2) | 2540 кДж | 3) | 317,5 кДж | 4) | 254 кДж |
3. В соответствии с термохимическим уравнением реакции
4Al(тв) + 3O2(г) = 2Al2O3(тв) + 3352 кДж
количество теплоты, выделяющееся при сгорании 270 г алюминия, равно
| 1) | 6704 кДж | 2) | 1340,8 кДж | 3) | 8380 кДж | 4) | 838 кДж |
4. В результате реакции, термохимическое уравнение которой
S(тв) + O2(г) = SO2(г) + 297 кДж,
выделилось 1188 кДж теплоты. Объем (н.у.) образовавшегося при этом сернистого газа равен
| 1) | 44,8 л | 2) | 89,6 л | 3) | 890 л | 4) | 112 л |
5. В результате реакции, термохимическое уравнение которой
2SO2(г) + O2(г) = 2SO3(г) + 198 кДж,
выделилось 990 кДж теплоты. Масса вступившего в реакцию сернистого газа равна
| 1) | 1280 г | 2) | 1600 г | 3) | 320 г | 4) | 640 г |
6. В соответствии с термохимическим уравнением реакции
2СО(г) + О2(г) = 2СО2(г) + 568 кДж
количество теплоты, выделившейся при сгорании 11,2 л (н.у.) оксида углерода(II), равно
| 1) | 113,6 кДж | 2) | 142 кДж | 3) | 284 кДж | 4) | 838 кДж |
7. В результате реакции, термохимическое уравнение которой
2KClO3(тв) = 2KCl(тв) + 3O2(г) + 90 кДж,
образовалось 224 л (н.у.) кислорода. Количество теплоты, выделившейся при этом, равно
| 1) | 450 кДж | 2) | 270 кДж | 3) | 300 кДж | 4) | 150 кДж |
8. В результате реакции, термохимическое уравнение которой
N2(г) + 3Н2(г) = 2NН3(г) + 92 кДж,
выделилось 46 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен
| 1) | 67, 2 л | 2) | 44,8 л | 3) | 11,2 л | 4) | 33,6 л |
9. В результате реакции, термохимическое уравнение которой
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г) + 802 кДж,
выделилось 160,4 кДж теплоты. Объем (н.у.) вступившего в реакцию кислорода равен
| 1) | 4,48 л | 2) | 13,44 л | 3) | 8,96 л | 4) | 11,2 л |
10. В результате реакции, термохимическое уравнение которой
4NH3(г) + 5O2(г) = 4NО(г) + 6H2O(г) + 902 кДж,
выделилось 451 кДж теплоты. Объем (н.у.) вступившего в реакцию аммиака равен
| 1) | 44,8 л | 2) | 112 л | 3) | 67,2 л | 4) | 22,4 л |
11. В результате реакции, термохимическое уравнение которой
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) + 1532 кДж,
образовалось 22,4 л (н.у.) азота. Количество выделившейся при этом теплоты равно
| 1) | 1532 кДж | 2) | 766 кДж | 3) | 306,4 кДж | 4) | 3064 кДж |
12. В результате реакции, термохимическое уравнение которой
2Н2(г) + О2(г) = 2Н2О(ж) + 572 кДж,
образовалось 7,2 г воды. Количество выделившейся при этом теплоты равно
| 1) | 114,4 кДж | 2) | 57,2 кДж | 3) | 143 кДж | 4) | 228,8 кДж |
13. В результате реакции, термохимическое уравнение которой
С(графит) + 2Н2(г) = СН4(г) + 74,6 кДж,
выделилось 373 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен
| 1) | 448 л | 2) | 56 л | 3) | 112 л | 4) | 224 л |
14. В результате реакции, термохимическое уравнение которой
CO2(г) + C(графит) = 2CO(г) – 173 кДж,
поглотилось 34,6 кДж теплоты. Объем (н.у.) образовавшегося при этом оксида углерода(II) равен
| 1) | 22,4 л | 2) | 4,48 л | 3) | 8,96 л | 4) | 11,2 л |
15. В результате реакции, термохимическое уравнение которой
Н2(г) + Сl2(г) = 2НСl(г) + 184,6 кДж,
образовалось 11,2 л (н.у.) хлороводорода. Количество выделившейся при этом теплоты равно
| 1) | 18,46 кДж | 2) | 37,92 кДж | 3) | 46,15 кДж | 4) | 92,3 кДж |
16. В соответствии с термохимическим уравнением реакции
С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж) + 2800 кДж
количество теплоты, выделяющееся при окислении 36 г глюкозы, равно
| 1) | 560 кДж | 2) | 280 кДж | 3) | 140 кДж | 4) | 420 кДж |
17. В соответствии с термохимическим уравнением реакции
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж) + 1410 кДж
количество теплоты, выделяющееся при образовании 8,8 г углекислого газа, равно
| 1) | 705 кДж | 2) | 70,5 кДж | 3) | 282 кДж | 4) | 141кДж |
18. В соответствии с термохимическим уравнением реакции
2С2Н6(г) + 7О2(г) = 4СО2(г) + 6Н2О(ж) + 3120 кДж
при сгорании 112 л (н.у.) этана количество выделившейся теплоты равно
| 1) | 15600 кДж | 2) | 7800 кДж | 3) | 3900 кДж | 4) | 1560 кДж |
19. В соответствии с термохимическим уравнением реакции
2С2Н2 + 5O2 = 4CO2 + 2H2O + 2610 кДж
при сгорании 26 г ацетилена количество выделившейся теплоты равно
| 1) | 1305 кДж | 2) | 5220 кДж | 3) | 522 кДж | 4) | 652,5 кДж |
20. В результате реакции, термохимическое уравнение которой
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374 кДж,
выделилось 458 кДж теплоты. Объем (н.у.) вступившего в реакцию кислорода равен
| 1) | 144,4 | 2) | 33,6 л | 3) | 67,2 л | 4) | 22,4 л |
21. В результате реакции, термохимическое уравнение которой
2NO(г) + O2(г) = 2NO2(г) + 114 кДж,
выделилось 570 кДж теплоты. Объем (н.у.) вступившего в реакцию оксида азота(II) равен
| 1) | 144,4 | 2) | 336 л | 3) | 112 л | 4) | 224 л |
22. В результате реакции, термохимическое уравнение которой
N2(г) + O2(г) = 2NO(г) – 180,8 кДж,
образовалось 56 л (н.у.) оксида азота(II). Количество поглотившейся при этом теплоты равно
| 1) | 90,4 кДж | 2) | 113 кДж | 3) | 226 кДж | 4) | 452 кДж |
23. В результате реакции, термохимическое уравнение которой
2AgNO3(тв) = 2Ag(тв) + 2NO2(г) + O2(г) – 317 кДж,
образовалось 10,8 г серебра. Количество поглотившейся при этом теплоты равно
| 1) | 31,7 кДж | 2) | 15,85 кДж | 3) | 63,4 кДж | 4) | 12,68 кДж |
Термодинамика химических процессов. Закон Гесса. Понятие об энтальпии, энтропии, энергии Гиббса*
1*. Определите ΔНо образования этилена по следующим данным:
| С(графит) + О2(г) = СО2(г), | ΔНº = - 393,5 кДж |
| Н2 + 1/2 О2(г) = Н2О(г), | ΔНо = - 241,8 кДж |
| С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(г), | ΔНо= - 1323 кДж |
2*. Вычислите ΔНо образования карбоната магния, используя следующие данные:
| С(графит) + О2(г) = СО2(г), | ΔНº = - 393,5 кДж |
| 2Мg(тв) + О2(г) = 2МgО(тв), | ΔНº = - 1203,6 кДж |
| МgО(тв) + СО2(г) = МgСО3(тв), | ΔНº = - 117,7 кДж |
3*. Рассчитайте ΔНº реакции 2Р(белый) + 5Cl2(г.) = 2РCl5(г.), используя следующие данные:
| 2Р(белый) + 3Cl2(г) = 2РCl3(г), | ΔНº = - 558,9 кДж |
| РCl3(г) + Cl2(г) = РCl5(г) | ΔНº = - 90,5 кДж |
4*. Оксид серы (VI) трудно получить при непосредственном сгорании серы в кислороде. Определите энтальпию образования SO3(г.), зная, что энтальпия образования SO2(г.) составляет – 297,1 кДж/моль, а энтальпия реакции окисления 1 моль SO2(г.) газообразным кислородом до SO3(г.) равна – 99,0 кДж.
5*. Определите энтальпию образования глюкозы по следующим данным:
| С(графит) + О2(г) = СО2(г), | ΔНº = - 393,5 кДж |
| Н2 + 1/2 О2(г) = Н2О(г), | ΔНо = - 241,8 кДж |
| С6Н12О6(тв) + 6О2(г) = 6СО2(г) + 6Н2О(г), | ΔНо= - 2538,8 кДж |
6*. Определите, какой из сульфидов можно растворить в разбавленной соляной кислоте, используя следующие данные:
| ZnS(тв) + 2HCl(р-р) = H2S(г) + ZnCl2(р-р), | ΔGº = - 462,6 кДж |
| PbS(тв)+ 2HCl(р-р) = H2S(г) + PbCl2(р-р), | ΔGº = + 31,0 кДж |
7*. Определите, можно ли синтезировать хлориды фосфора из простых веществ при стандартных условиях, используя следующие данные:
| Р(белый) + 3/2Cl2 = РCl3(г), | ΔGº = - 286,7 кДж |
| Р(белый) + 5/2Cl2 = РCl5(г), | ΔGº = - 325,1 кДж |
8*. Определите, какой из углеводородов можно получить из простых веществ при стандартных условиях, используя следующие данные:
| С(графит) + Н2(г) = СН4(г), | ΔGº = - 50,5 кДж |
| 2С(графит) + 2Н2(г) = С2Н4(г), | ΔGº = + 68,1 кДж |
| 2С(графит) + Н2(г) = С2Н2(г), | ΔGº = + 209,9 кДж |
9*. Определите, какие из тетрагалогеналканов можно получить из простых веществ при стандартных условиях, используя следующие данные:
| С(графит) + 2F2(г) = СF4(г), | ΔGº = - 636,0 кДж |
| С(графит) + 2Cl2(г) = СCl4(г), | ΔGº = - 64,1 кДж |
| С(графит) + 2Br2(г) = СBr4(г), | ΔGº = + 36,0 кДж |
| С(графит) + 2I2(г) = СI4(г), | ΔGº = + 124,9 кДж |
10*. Определите, какой из гидроксидов (II) наиболее устойчив к окислению при стандартных условиях, используя следующие данные:
| Fe(OH)2(тв) + 1/4О2(г) + 1/2Н2О(ж) = Fе(ОН)3(тв), | ΔGº = - 92,2 кДж |
| Со(OH)2(тв) + 1/4О2(г) + 1/2Н2О(ж) = Со(ОН)3(тв), | ΔGº = - 23,7 кДж |
| Ni(OH)2(тв) + 1/4О2(г) + 1/2Н2О(ж) = Ni(ОН)3(тв), | ΔGº = + 22,9 кДж |
11*. Энтропия системы возрастает в процессах
| 1) | СаО(тв) + SO2(г) = CaSO3(тв) |
| 2) | Fe3O4(тв) + 4Н2(г) = 3Fe(тв) + 4Н2О(ж) |
| 3) | С6Н12О6(тв) + 6О2(г) = 6СО2(г) + 6Н2О(г) |
| 4) | 2H2(г) + О2(г) = 2Н2О(ж) |
| 5) | СаСО3(тв) = СаО(тв) + СО2(г) |
| 6) | 2Сu(NO3)2(тв) = 2CuO(тв) + 4NO2(г) + О2(г) |
12*. Энтропия системы возрастает в процессах
| 1) | (NH4)2Cr2O7(тв) = Cr2O3(тв) + N2(г) + 4H2O(г) |
| 2) | Fe2O3(тв) + 3Н2(г) = 2Fe(тв) + 3Н2О(ж) |
| 3) | NH4NO2(тв) = N2(г) + 2Н2О(г) |
| 4) | NH4Сl(тв) = NH3(г) + НСl(г) |
| 5) | СаО(тв) + СО2(г) = СаСО3(тв) |
| 6) | 2Fe(тв) + 3Cl2(г) = 2FeCl3(тв) |
13*. Энтропия системы уменьшается в процессах
| 1) | N2(г) + 3Н2(г) = 2NН3(г) |
| 2) | 2KClO3(тв) = 2KCl(тв) + 3O2(г) |
| 3) | 4Al(тв) + 3O2(г) = 2Al2O3(тв) |
| 4) | СН4(г) = С(тв) + 2Н2(г) |
| 5) | NH4NO3(тв) = N2O(г) + 2Н2О(г) |
| 6) | MgО(тв) + СО2(г) = MgСО3(тв) |
14*. Энтропия системы уменьшается в процессах
| 1) | 2NН3(г) = N2(г) + 3Н2(г) |
| 2) | 3Са(тв) + N2(г) = Ca3N2(тв) |
| 3) | 2Al(тв) + 3Cl2(г) = 2AlCl3(тв) |
| 4) | 2KNO3(тв) = 2KNO2(тв) + О2(г) |
| 5) | 2KMnO4(тв) = K2MnO4(тв) + MnO2(тв) + O2(г) |
| 6) | CH3NH2(г) + HBr(г) = CH3NH3Br(тв) |






