21. Обратимыми являются реакции
| 1) | NH4OH = NH3 + H2O |
| 2) | KOH + HCl = KCl + H2O |
| 3) | PCl3 + Cl2 = PCl5 |
| 4) | СаO + 2HCl = СаCl2 + H2O |
| 5) | N2 + 3H2 = 2NH3 |
| 6) | 2НNO3 + BaCO3 = Ba(NO3)2 + CO2 + H2O |
22. Практически необратимыми являются реакции
| 1) | С + CО2 = 2СO |
| 2) | 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl |
| 3) | 2SO2 + O2 = 2SO3 |
| 4) | C + 2H2 = CH4 |
| 5) | Ca(OH)2 + H2SO4 = CaSO4 +2H2O |
| 6) | 2НCl + CaCO3 = CaCl2 + CO2 + H2O |
23. Химическое равновесие можно сместить в сторону продуктов реакции при одновременном увеличении давления и уменьшении температуры в системах
| 1) | NH4Сl(тв)  NH3(г) + HCl(г) – Q NH3(г) + HCl(г) – Q
|
| 2) | H2(г) + Сl2(г)  2HCl(г) + Q 2HCl(г) + Q
|
| 3) | PCl3(г) + Cl2(г)  PCl5(г) + Q PCl5(г) + Q
|
| 4) | 2NO(г) + O2 (г)  2NO2 (г) + Q 2NO2 (г) + Q
|
| 5) | N2(г) + 3H2(г)  2NH3(г) + Q 2NH3(г) + Q
|
| 6) | C4H10 (г)  C4H8 (г) + H2 (г) – Q C4H8 (г) + H2 (г) – Q
|
24. Химическое равновесие можно сместить в сторону продуктов реакции при одновременном уменьшении давления и увеличении температуры в системах
| 1) | HCl(г) + NH3(г)  NH4Сl(тв) + Q NH4Сl(тв) + Q
|
| 2) | N2(г) + O2(г)  2NO(г) – Q 2NO(г) – Q
|
| 3) | СО(г) + 2Н2(г)  СН3ОН(г) + Q СН3ОН(г) + Q
|
| 4) | 2CO2(г)  2CO(г) + O2(г) – Q 2CO(г) + O2(г) – Q
|
| 5) | 2NH3(г)  N2(г) + 3H2(г) – Q N2(г) + 3H2(г) – Q
|
| 6) | C4H10 (г)  C4H8 (г) + H2 (г) – Q C4H8 (г) + H2 (г) – Q
|
25 *. При некоторой температуре равновесие реакции А + 2В  С устанавливается при следующих равновесных концентрациях: [A] = 0,1 моль/л, [В] = 0,2 моль/л, [С] = 0,3 моль/л. Константа равновесия реакции равна ________ (моль/л)-2. (Запишите число с точностью до целых.)
С устанавливается при следующих равновесных концентрациях: [A] = 0,1 моль/л, [В] = 0,2 моль/л, [С] = 0,3 моль/л. Константа равновесия реакции равна ________ (моль/л)-2. (Запишите число с точностью до целых.)
26 *. При некоторой температуре равновесие реакции 2А + В  2С устанавливается при следующих равновесных концентрациях: [A] = 0,2 моль/л, [В] = 0,1 моль/л, [С] = 0,4 моль/л. Константа равновесия реакции равна ________ (моль/л)-1. (Запишите число с точностью до целых.)
2С устанавливается при следующих равновесных концентрациях: [A] = 0,2 моль/л, [В] = 0,1 моль/л, [С] = 0,4 моль/л. Константа равновесия реакции равна ________ (моль/л)-1. (Запишите число с точностью до целых.)
27 *. При некоторой температуре равновесие реакции А + В  2С устанавливается при следующих равновесных концентрациях: [A] = 0,2 моль/л, [В] = 0,1 моль/л, [С] = 0,05 моль/л. Константа равновесия реакции равна ________. (Запишите число с точностью до тысячных.)
2С устанавливается при следующих равновесных концентрациях: [A] = 0,2 моль/л, [В] = 0,1 моль/л, [С] = 0,05 моль/л. Константа равновесия реакции равна ________. (Запишите число с точностью до тысячных.)
28 *. При некоторой температуре равновесие реакции А + 3В  2С устанавливается при следующих равновесных концентрациях: [A] = 0,01 моль/л, [В] = 0,4 моль/л, [С] = 0,04 моль/л. Константа равновесия реакции равна ________ (моль/л)-2. (Запишите число с точностью до десятых.)
2С устанавливается при следующих равновесных концентрациях: [A] = 0,01 моль/л, [В] = 0,4 моль/л, [С] = 0,04 моль/л. Константа равновесия реакции равна ________ (моль/л)-2. (Запишите число с точностью до десятых.)
Электролитическая диссоциация. Реакции ионного обмена
Базовый уровень сложности
1. Слабым электролитом является
| 1) | H2S | 2) | H2SO4 | 3) | K2S | 4) | K2SO4 |
2. Сильным электролитом является
| 1) | H2S | 2) | HF | 3) | K2S | 4) | NH4OH |
3. Наиболее слабым электролитом является
| 1) | H2О | 2) | H2S | 3) | H2Se | 4) | H2Te |
4. Электрическая лампочка загорится при опускании электродов в водный раствор
| 1) | этанола | 3) | хлорида аммония |
| 2) | сахара | 4) | глюкозы |
5. Электрическая лампочка загорится при опускании электродов в
| 1) | водный раствор этилового спирта |
| 2) | безводную серную кислоту |
| 3) | водный раствор ацетата калия |
| 4) | бензол |
6. Ионы Br- образуются при диссоциации
| 1) | CH3Br | 2) | CaBr2 | 3) | NaBrO4 | 4) | NaBrO3 |
7. Наибольшее количество ионов образуется при диссоциации 1 моль
| 1) | карбоната натрия | 3) | хлорида кальция |
| 2) | сульфата алюминия | 4) | ацетата натрия |
8. В качестве анионов только анионы ОН- образуются при диссоциации
| 1) | C2H5ОН | 2) | MgOHCl | 3) | HCOOH | 4) | Ba(OH)2 |
9. В качестве катионов только катионы Н+ образуются при диссоциации
| 1) | КHCO3 | 2) | CH3ОН | 3) | HCOOH | 4) | NaOH |
10. Ступенчатая диссоциация возможна в растворе
| 1) | азотной кислоты |
| 2) | гидроксида натрия |
| 3) | хлорида алюминия |
| 4) | дигидрофосфата натрия |
11. Какие из приведенных утверждений верны?
А. При диссоциации основания образуют только один вид анионов – гидроксид-ионы ОН-.
Б. Степень электролитической диссоциации уменьшается при уменьшении концентрации раствора электролита.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
12. Одновременно в растворе не могут находиться ионы
| 1) | Al3+ и Br- | 3) | SO 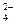 и Cu2+ и Cu2+
|
| 2) | Ca2+ и NO 
| 4) | Fe2+ и S2- |
13. Одновременно в растворе могут находиться ионы
| 1) | Al3+ и OH- | 3) | SO 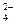 и Cu2+ и Cu2+
|
| 2) | Ag+ и Cl- | 4) | Cu2+ и S2- |
14. Одновременно в растворе могут находиться ионы
| 1) | Ва2+, K+, ОН-, SO 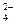
| 3) | Na+, Cl-, NO  , Al3+ , Al3+
|
| 2) | Fe3+, ОН-, Ca2+, Br- | 4) | H+, NO  , SiO , SiO 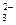 , K+ , K+
|
15. Одновременно в растворе не могут находиться ионы
| 1) | Cа2+, Na+, ОН-, РO 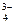
| 3) | Сa2+, Br-, NO  , Al3+ , Al3+
|
| 2) | SO 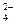 , ОН-, Na+, Cl- , ОН-, Na+, Cl-
| 4) | ОН-, NO  , SiO , SiO 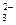 , Na+ , Na+
|
16. Осадок выпадает при взаимодействии растворов
| 1) | гидроксида натрия и азотной кислоты |
| 2) | силиката натрия и азотной кислоты |
| 3) | соляной кислоты и карбоната калия |
| 4) | хлорида аммония и гидроксида калия |
17. Осадок выпадает при взаимодействии
| 1) | HCl(р-р) и CuO |
| 2) | NaOH(р-р) и H3PO4 (р-р) |
| 3) | H2SO4(р-р) и Al(OH)3 |
| 4) | AgNO3(р-р) и KCl(р-р) |
18. Осадок образуется при взаимодействии раствора КОН с
| 1) | HNO3 | 2) | NH4Сl | 3) | SO3 | 4) | FeSO4 |
19. Газ выделяется при взаимодействии растворов
| 1) | гидроксида калия и соляной кислоты |
| 2) | карбоната натрия и хлорида кальция |
| 3) | соляной кислоты и карбоната натрия |
| 4) | хлорида бария и серной кислоты |
20. Газ выделяется при взаимодействии
| 1) | HCl(р-р) и FeS |
| 2) | Ca(OH)2(р-р) и CO2 |
| 3) | H2SO4(р-р) и NaOH(р-р) |
| 4) | HNO3(р-р) и MgO |
21. Газ выделяется при взаимодействии соляной кислоты с
| 1) | гидроксидом калия | 3) | оксидом лития |
| 2) | карбонатом кальция | 4) | аммиаком |
22. Сокращенное ионное уравнение
Ba2+ + SO 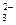 = BaSO3
= BaSO3
соответствует взаимодействию между веществами
| 1) | BaCO3 и Na2SO3 |
| 2) | BaCl2 и SO3 |
| 3) | Ba(NO3)2 и Na2SO3 |
| 4) | Ba(OH)2 и H2SO3 |
23. Сокращенное ионное уравнение
Сa2+ + СO 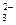 = СaСO3
= СaСO3
соответствует взаимодействию между веществами
| 1) | Ca(OH)2 и CO2 |
| 2) | CaCl2 и Na2CO3 |
| 3) | CaO и CO2 |
| 4) | CaSO4 и K2CO3 |
24. Сокращенное ионное уравнение
Fe3+ + 3ОН- = Fe(OH)3
соответствует взаимодействию между веществами
| 1) | FeCl2 и NaOH |
| 2) | FeSO4 и KOH |
| 3) | FeРO4 и NaOH |
| 4) | Fe2(SO4)3 и KOH |
25. Сокращенному ионному уравнению
H+ + ОН- = H2O
соответствует молекулярное уравнение
| 1) | H2S + 2KOH = K2S + 2H2O |
| 2) | Fe(OH)2 + H2SO4 = FeSO4 + 2H2O |
| 3) | HNO3 + NaOH = NaNO3 + H2O |
| 4) | Ca(OH)2 + H2SO4 = CaSO4 + 2H2O |
26*. Произведение растворимости сульфата бария равно 1,1 ∙ 10-10. Осадок сульфата бария выпадет, если смешать равные объемы растворов сульфата натрия и хлорида бария, концентрации которых (моль/л) соответственно равны
| 1) | 2 ∙ 10-6 и 1 ∙ 10-4 | 3) | 1 ∙ 10-5 и 0,2 ∙ 10-5 |
| 2) | 5 ∙ 10-5 и 4 ∙ 10-6 | 4) | 5 ∙ 10-4 и 2 ∙ 10-6 |
27*. Наибольшая концентрация (моль/л) ионов Ag+ образуется в насыщенном растворе соли, произведение растворимости которой
| 1) | ПРAgCl = 1,77 ∙ 10-10 | 3) | ПРAgI = 8,52 ∙ 10-17 |
| 2) | ПРAgBr = 5,35 ∙ 10-13 | 4) | ПРAgSCN = 1,03 ∙ 10-12 |
28*. В соответствии со значениями произведений растворимости при 25˚С: ПРВаСО3 = 2,6 ∙ 10-9, ПРBaSeO4 = 3,4 ∙ 10-8, ПРBaMoO4 = 3,5 ∙ 10-8, ПРBaSO4 = 1,1 ∙ 10-10 наибольшая полнота осаждения ионов Ва2+ достигается добавлением раствора соли
| 1) | Na2CO3 | 3) | Na2MoO4 |
| 2) | Na2SeO4 | 4) | Na2SO4 |
29*. В соответствии со значениями произведений растворимости при 25˚С: ПРCaSО4 = 4,9 ∙ 10-5, ПРPbSO4 = 2,5 ∙ 10-8, ПРSrSO4 = 3,4 ∙ 10-7, ПРBaSO4 = 1,1 ∙ 10-10 наименьшую растворимость в воде при данной температуре имеет соль
| 1) | CaSО4 | 3) | SrSO4 |
| 2) | PbSO4 | 4) | BaSO4 |






