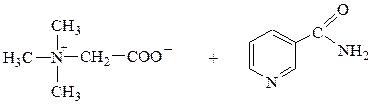
бетаин никотинамид
- Среди участников реакций найти субстрат, т.е. молекулу с атомом углерода в Sp3-гибридизации, связанным с гетероатомом полярной s-связью:
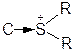
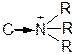
C®Hal, C®OR,
| 
|
| 
|
| 
|
| 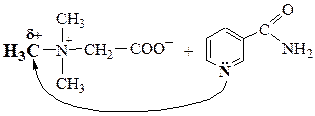
|
| 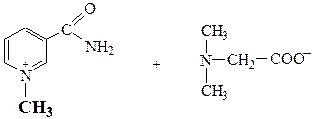
|
- Общая схема реакции:
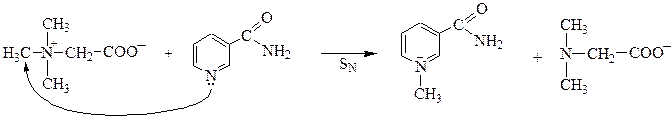
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ К АЛЬДЕГИДАМ И КЕТОНАМ, AN


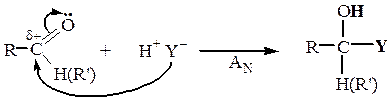
| Присоединение воды | 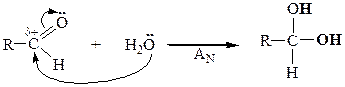
|
| Присоединение спиртов |
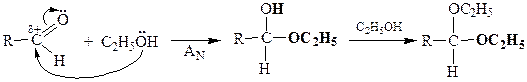 полуацеталь ацеталь
полуацеталь ацеталь
|
| Присоединение аммиака и аминов | 
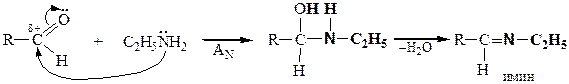
|
| Альдольная конденсация |
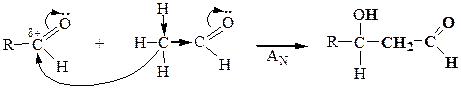 a-СН-кислотный центр
a-СН-кислотный центр
|
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В КАРБОНОВЫХ КИСЛОТАХ
И ИХ ФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ


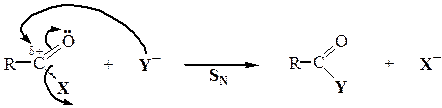
| Карбоновые кислоты | 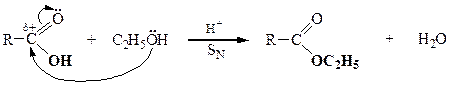
|
| Амиды кислот | 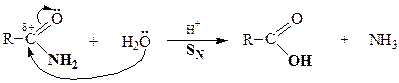
|
| Сложные эфиры | 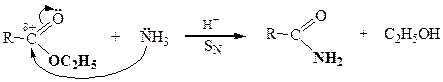
|
| Сложные тиоэфиры | 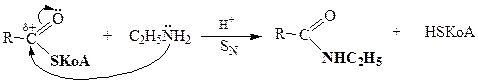
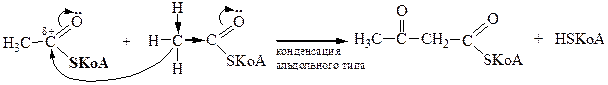 α-СН-кислотный центр
α-СН-кислотный центр
|
| Ангидриды кислот |  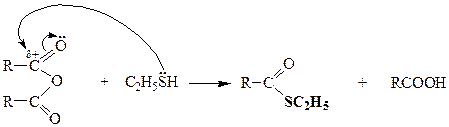
 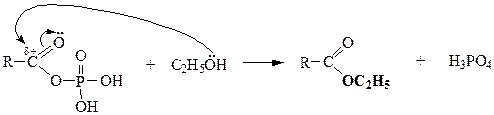
|
ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Окислительно-восстановительные реакции – это реакции, идущие с передачей электронов от восстановителя к окислителю, в результате чего изменяются степени окисления элементов.
Окисление:
|
(в.ф. – восстановленная форма, о.ф. – окисленная форма)
Восстановление:
|
В окислительно-восстановительных реакциях органических соединений происходит изменение степени окисления атома углерода в диапазоне от –4 до +4.
Степень окисления любого атома углерода в органических соединениях равна сумме числа его связей с атомами более электроотрицательных элементов (О, N, S), взятых со знаком «+», и числа связей с атомами водорода, взятых со знаком «–», а связи с соседними атомами углерода не учитываются.
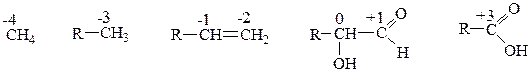
В качестве окислителей в органической химии чаще всего применяют: KMnO4, K2Cr2O7, HNO3, HClO4, O2, H2O2, CuO, MnO2, Ag2O, галогены.
В органических соединениях труднее всего окисляются sp3-гибридные атомы углерода и бензольное кольцо. Примеры окисления разных классов соединений приведены в таблице на следующей странице.
ОВ-реакции, протекающие в организме, можно разделить на 3 типа:
1. дегидрогеназное окисление (потеря 2Н);
2. оксигеназное окисление (введение одного или двух атомов кислорода);