В пробирку внести 2-3 капли бромной воды и 1-2 капли концентрированного 25%-ного раствора аммиака (NH3). Как изменится окраска бромной воды? Написать уравнение реакции окисления - восстановления между бромной водой и аммиаком.
Опыт 3. Азотистая кислота
а) В пробирку поместить 2 капли раствора перманганата калия (KMnO4), подкислить его двумя каплями раствора серной кислоты (H2SO4) с молярной концентрацией эквивалента 1 моль/л и затем добавить несколько капель раствора нитрита калия (KNO2) до обесцвечивания раствора. Объяснить причины обесцвечивания раствора. Написать уравнение реакции между нитритом калия (KNO2) и перманганатом калия (KMnO4) в кислой среде.
б) Внести в пробирку 3 капли раствора иодида калия (KJ), 5 капель серной кислоты (H2SO4) с молярной концентрацией эквивалента 1 моль/л, 5 капель органического растворителя; к этой смеси прибавить 2 капли нитрита калия (KNO2), встряхнуть пробирку. Что наблюдается? Написать уравнение реакции взаимодействия иодида калия (KJ) и нитрита калия (KNO2) в сернокислой среде учитывая, что нитрит-ион переходит в оксид азота (II) (NO).
Сопоставить опыты а) и б) В какой случае азотистая кислота (HNO2) - окислитель, а в каком - восстановитель?
ФОСФОР
Опыт 1. Гидролиз растворимых фосфатов
В три пробирки поместить по 1-2 мл раствора дигидрофосфатата ( NaH2PO4), гидрофосфатата (Na2HPO4 ) и фосфата натрия ( Na3PO4). Определить рН с помощью индикатора. Написать уравнения гидролиза в полном молекулярном и сокращенном ионном виде.
Опыт 2. Фосфаты кальция
Гидрофосфаты (Ca(HPO4)2 ) и дигидрофосфаты кальция (Ca(HPO4)2 ) находят широкое применение в качестве удобрений: дигидрофосфат кальция (Ca(HPO4)2 ) – суперфосфат, гидрофосфат аммония – диаммофос и др. Природные соединения фосфора (фосфориты и апатиты) содержат среднюю соль кальция. Соли фосфорной кислоты разного типа (по числу замещенных атомов водорода) обладают разными свойствами.
В три пробирки налить 5 капель раствора хлорида кальция (CaCl2). В первую добавить столько же капель раствора дигидрофосфата натрия ( NaH2PO4), во вторую – гидрофосфата натрия (Na2HPO4 ), в третью – сначала 5 капель гидроксида аммония (NH4OH), затем – гидрофосфора натрия (Na2HPO4 ). Написать уравнения происходящих реакций в молекулярном и ионном видах. К полученным осадкам гидрофосфата (Ca(HPO4)2 ) и дигидрофосфата кальция (Ca(HPO4)2 ) прилить по 5 капель уксусной кислоты (CH3COOH). Написать уравнения реакций.
Контрольные вопросы:
1. Чему равны значения степени окисления азота? Приведите примеры соответствующих соединений.
2. Какие окислительно-восстановительные свойства могут проявлять: Na2SO3, H2SO4, Na2S?
3. Какой тип реагента (окислитель или восстановитель) следует использовать для осуществления следующих превращений:
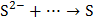 ,
,
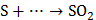 ,
,
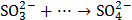 ,
,
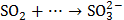 ,
,
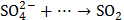 ?
?
4. Укажите возможные продукты в следующих превращениях:
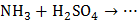 ,
,
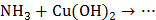 ,
,
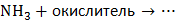 ,
,
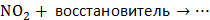 ,
,
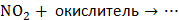 .
.
5. Какими свойствами обладают соединения фосфора с водородом?
Тема 7.
d-элементы
В периодической системе d-элементы или переходные металлы расположены в побочных подгруппах всех восьми групп. На внешнем энергетическом уровне у атомов этих элементов находится один или два s-электрона (поэтому эти элементы проявляют свойства металлов), и идет заполнение d-подуровня предыдущего энергетического уровня. Поскольку на d-подуровне имеется только пять орбиталей, то в каждом периоде имеется десять d-элементов. Общую электронную формулу валентного слоя d-элементов можно выразить формулой: ns2(n-1)d1-10. Наиболее устойчивыми состояниями для переходных металлов являются состояния: а) когда d-орбитали предпоследнего электронного уровня полностью заняты электронами (цинк, кадмий, ртуть); б) когда d-орбитали предпоследнего электронного уровня заполнены наполовину (т. е. содержат по одному электрону на каждой d-орбитали), как у марганца, технеция и рения. При переходе одного s-электрона на d-орбиталь предыдущего энергетического уровня у металлов: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au достигается более устойчивое электронное состояние. Поскольку энергии этих двух подуровней различаются незначительно, то переход s-электрона внешнего энергетического уровня на d-орбиталь предыдущего энергетического уровня происходит без больших затрат энергии. В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня. В образовании связей могут участвовать все или только часть d-электронов предпоследнего энергетического уровня, поэтому образуются соединения с различной валентностью и степенью окисления (кроме d-элементов III и II групп). У d-элементов одного периода изменяется число d-электронов, следовательно, изменяются физические и химические свойства элементов, расположенных в одном периоде. У d-элементов, расположенных в одной группе периодической системы, число d-электронов остается постоянным. С увеличением числа электронных слоев увеличивается радиус, поэтому происходит изменение свойств. Особенностью d-элементов одной группы является медленное возрастание атомного радиуса с возрастанием порядкового номера элемента и с увеличением общего числа электронов.
Свойства d-элементов пятого и шестого периода близки по своим свойствам, так как (за счет f-сжатия у элементов шестого периода) радиусы этих элементов по величине примерно одинаковы. Особенностями электронного строения d-элементов обусловлены и их свойства: а) большое разнообразие проявляемых валентностей и степеней окисления; б) способность образовывать различные комплексные соединения.
Химические свойства.
С увеличением порядкового номера в побочных подгруппах металлические свойства элементов уменьшаются. Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается. Наиболее сильными восстановителями являются металлы III-Б группы. У большинства d-элементов образуются защитные оксидные пленки, вызывающие их пассивацию и предохраняющие их от коррозии. Наиболее склонны к пассивации металлы IV-VI групп. Элементы III и II-Б групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а лантан взаимодействует и с водой. Не взаимодействуют с разбавленными кислотами металлы I-Б группы, ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt). Общим свойством d-элементов является способность образовывать соединения, в которых они проявляют различные степени окисления (кроме d-элементов II группы: цинка и кадмия). Поэтому для большинства d-элементов характерны окислительно-восстановительные реакции. Строение и свойства соединений d-элементов зависят от степени окисления металла. Большинство соединений d-элементов с низшей степенью окисления проявляют восстановительные свойства. Переходные металлы, проявляющие переменную валентность, в низшей степени окисления с сильными окислителями образуют соединения, как правило, ионного типа с основными или амфотерными свойствами. Соединения d-элементов со слабыми окислителями (N, B, C, H, S, Si) являются металлоподобными веществами, обладающими электрической проводимостью. Некоторые из соединений обладают сверхпроводимостью при низких температурах. Для соединений, d-элементов, в которых металл находится в высшей степени окисления, характерны кислотные и окислительные свойства, при этом они образуют полярные ковалентные химические связи. С увеличением степени окисления в соединениях d-элементов усиливаются кислотные и окислительные свойства:
Mn+2O – Mn+32O3 – Mn+4O2 – Mn+6O3 – Mn+72O7
Mn(OH)2 – Mn(OH)3 – Mn(OH)4 – H2MnO4 – HMnO4
→ Кислотные свойства усиливаются, основные свойства уменьшаются
→ Окислительные свойства усиливаются, восстановительные уменьшаются
Так как атомы d-элементов и их ионы имеют большое число вакантных орбиталей на внешнем (s- и р-орбитали) и предвнешнем (d- и у многих f-орбитали) энергетическом уровне и относительно большой радиус, то для них характерны реакции комплексообразования.
Прочность комплексов с одинаковыми лигандами возрастает с увеличением заряда иона металла и с уменьшением его радиуса. Так как переходные металлы и их ионы имеют неспаренные электроны, способные при поглощении световой энергии переходить с основных энергетических уровней и подуровней на более высокие уровни (в возбужденное состояние), то большинство ионов металлов и их соединений окрашены. Окраска зависит от разности энергии основного и возбужденного состояния и длины поглощаемого света. Многие d-элементы, особенно металлы VIII и I групп используются в качестве катализаторов для различных реакций.
Лабораторная работа № 7
Химия соединений d-элементов
Цель работы: Изучение свойств соединений некоторых d-элементов.
Меры предосторожности при выполнении работы:
1. Соблюдать особую осторожность при работе с пероксидом водорода (H2O2) и бромной водой (могут вызывать ожоги кожного покрова). Нельзя, сбрасывать их остатки в раковину. Слив под тягой в спецприемник.
2. Растворы серной кислоты добавлять только по каплям, большие объемы вливать сразу запрещается.
3. Нагревание растворов в пробирках проводить осторожно, внося в верхнюю часть пламени горелки. Не допускать выброса содержимого пробирки вследствие перегрева. Не направлять отверстие пробирки в строну работающих.
4. С концентрированным раствором аммиака работать под тягой!






