В две пробирки налить по 2-3 мл пероксида водорода (H2O2) и по 1 мл раствора серной кислоты. В одну пробирку добавить 2-3 капли раствора перманганата калия (KMnO4), а в другую – 4-5 капель раствора йодида калия (KI). Что наблюдается в каждой пробирке? Экспериментально доказать выделение йода! Написать уравнения реакций. Уравнять и указать окислитель и восстановитель.
Опыт 5. Реакции диспропорционирования
а) В пробирку с 4-5 каплями раствора нитрита натрия (NaNO2) прилить равный объем разбавленной серной кислоты. Слегка нагреть (тяга!). Обосновать наблюдаемый эффект с помощью уравнения химической реакции.
Б) Написать уравнения реакций взаимодействия хлора с концентрированными растворами (холодным и горячим) щелочи. Подобрать коэффициенты.
Опыт 6. Восстановление иона MnO4- в различных средах
В три отдельные пробирки с раствором пермаганата натрия (KMnO4) добавить разбавленную серную кислоту (H2SO4), во вторую – такой же объем воды; в третью – концентрированный раствор щелочи (NaOH или KOH). Затем в каждую из пробирок добавить раствор сульфата натрия (Na2SO4). Объяснить наблюдаемое, имея в виду образование в кислой среде Mn2+, в нейтральной – MnO2, в сильнощелочной – ионов MnO42-.
Опыт 7. Окислительно- восстановительные свойства соединений хрома (III)
А) К 3-4 каплям раствора соли хрома (III) прибавить по каплям раствор щелочи до образования осадка, после чего прилить по каплям раствор бромной воды до изменения окраски (при необходимости подогреть).
б) К 3-4 каплям раствора хлорида хрома (III) (CrCl3) прилить 2 капли раствора хлороводородной кислоты. Подученный раствор разделить на две пробирки, одну оставить для контроля, а в другую поместить кусочек цинка. Через несколько минут наблюдать изменение окраски пробирки с цинком.
В чем проявляется окислительно-восстановительная двойственность соединений хрома (III)?
Опыт 8. Взаимные переходы хромат (CrO4-) и
бихромат - ионов (Cr2O72-)
К 3-4 каплям раствора хромата калия (KCrO4) прилить раствор кислоты до изменения окраски раствора.
К 3-4 каплям раствора бихромата калия (K2Cr2O7) прилить по каплям раствор щелочи до изменения цвета раствора. Написать в молекулярном и ионном виде уравнения обеих реакций и указать окраску растворов хромат- и бихромат – ионов. Указать роль кислотности среды.
Опыт 9. Окислительные свойства хрома (VI)
К 3-4 каплям раствора бихромата калия (K2Cr2O7) прилить раствор серной кислоты (1:4) (H2SO4) и по каплям раствор сульфита натрия (Na2SO3) или нитрита натрия (NaNO2) до явления устойчивой зеленой окраски.
Написать уравнение окислительно-восстановительной реакции, подобрать коэффициенты. Указать окислитель, восстановитель.
Контрольные вопросы:
На примерах показать принципиальное различие трех типов окислительно-восстановительных реакций (примеры произвольные).
2. Для каких соединений хрома характерны окислительные свойства? Привести примеры реакций, в которых проявляются эти свойства.
3. В какой среде – кислой или щелочной – наиболее выражены окислительные свойства хрома (VI)? Восстановительные свойства хрома (III)? Чем это объясняется?
4. Закончить уравнения реакций и расставить коэффициенты:
NaCrO2+2 + NaOH →
CrCl 3+NaBiO3+NaOH →
Cr2(SO4)3+Br2+NaOH →
K2Cr2O7 + SO2+H2SO4 →
K2Cr2O7 + FeSO4 + H2SO4 →
FeO•Cr2O3 + O2+K2CO3 →
Fe2O3 +К2СгO4 + СO2 →
5. Закончить уравнения реакций:
КМпO4 + НС1(конц.) →
KMnO4 + H 2S + H 2O →
МпO 2 + НС1(конц.) →
KMnO 4 + KI + H 2SO 4 →
MnSO 4+(NH 4) 2S 2O 8+H 2O →
6. Что произойдет, если к раствору иодида калия добавить по каплям хлорную воду? Написать уравнение реакции. Указать окислитель и восстановитель.
7. Будет ли изменяться степень окисления азота при действии на подкисленный раствор нитрита натрия соответственно раствора перманганата калия и иодида калия? Какие свойства – окислительные или восстановительные – проявляют при этом взаимодействующие компоненты?
Написать примеры уравнений реакций, в которых демонстрируются окислительные и восстановительные свойства пероксида водорода. Показать влияние среды на направление реакций.
Тема 6
Химия р -элементов. Сера. Фосфор. Азот.
р-элементами называют химические элементы, в атомах которых электрон с наивысшей энергией занимает р -орбиталь.
Каждый последующий р -элемент в группах в большей мере проявляет свойства неметалла, а его металлические свойства ослабевают. Орбитальные радиусы атомов с увеличением порядкового номера р -элемента в периоде уменьшаются, а энергия ионизации в общем возрастает.
Свойства р -элементов каждой подгруппы близки – все они являются электронными аналогами. В подгруппах с возрастанием порядкового номера р -элемента размеры атомов в общем увеличиваются, а энергия ионизации уменьшается. Электроотрицательность элементов при переходе в периоде от группы III к VII увеличивается, а в подгруппах сверху вниз уменьшается. Таковы общие тенденции изменения рассматриваемых констант.
Сера – химически активное вещество, особенно при повышенных температурах. Она непосредственно соединяется с многими простыми веществами, за исключением инертных газов, а так же азота N, теллура Te, йода I, платина Pt, золото Au. Однако соединения серы с азотом, теллуром, йодом, платиной и золотом синтезированы косвенными методами.
Для серы характерны окислительно-восстановительные реакции, при которых степень ее окисления изменяется по цепочке: минус 2, 0, +4, +6:
H2S-2 ⇄ S0 ⇄ S4+O2 ⇄ S6+O3
Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами, имеющими меньшую электроотрицательность). При комнатной температуре сера окисляет щелочные и щелочноземельные металлы, медь, серебро и ртуть с образованием сульфидов:
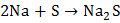 ,
,
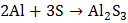 ,
,
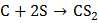 ,
,
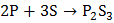 .
.
Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам, кислотам-окислителям). Так, сера сгорает во фторе с образованием SF6. Реакция серы с хлором и бромом сильно ускоряется при нагревании:
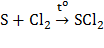 .
.
Взаимодействие со сложными веществами. Как восстановитель сера взаимодействует с кислотами-окислителями (HNO3, H2SO4):
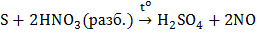 ,
,
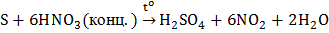 ,
,
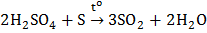 .
.
В воде сера не растворяется и даже не смачивается. Однако при высоких температурах сера диспропорционирует в атмосфере водяного пара:
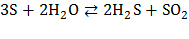 .
.
Проявляя свойства и окислителя, и восстановителя, сера вступает в реакции диспропорционирования с растворами щелочей при нагревании:
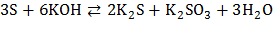 .
.
Азот. Название элемента происходит от греческого «азот» − безжизненный, латинское название «nitrogenium» − рождающий селитру.
Молекула азота состоит из двух атомов N≡N, они прочно связаны друг с другом, чем и объясняется большая инертность азота при обычных условиях. Пассивность газообразного азота используют в технологии для создания инертной атмосферы для протекания химических реакций.
В химических реакциях азот может быть и окислителем и восстановителем.
Азот взаимодействует как окислитель:
а) при нагревании с литием Li, магнием Mg, кальцием Ca, титаном Ti с образованием нитридов:
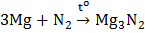 ;
;
б) при очень высокой температуре и в присутствии катализатора с водородом:
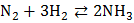 .
.
Азот взаимодействует как восстановитель:
а) с кислородом при очень высокой температуре:
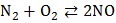 ;
;
другие оксиды азота при взаимодействии азота с кислородом не образуются;
б) с фтором:
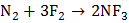 .
.
Фосфор обладает большим радиусом атома, чем азот, вследствие чего обладает меньшим сродством к электрону.
Фосфор химически более активен, чем азот. Химическая активность фосфора зависит от аллотропической модификации, в которой он находится. Так, наиболее активен белый фосфор, а наименее активен черный фосфор.
Фосфор непосредственно взаимодействует со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образование фосфидов:
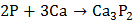 .
.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой. При этом в зависимости от условий проведения реакции могут образоваться как соединения фосфора (III), так и соединения фосфора (V).
а) При медленном окислении или при недостатке кислорода образуется фосфористый ангидрид:
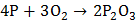 ,
,
При сгорании фосфора в избытке кислорода образуется фосфорный ангидрид:
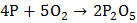 .
.
б) В зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и с серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора:
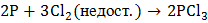 ,
,
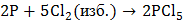 ,
,
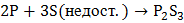 ,
,
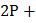 5S→
5S→  .
.
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
с разбавленной азотной кислотой: 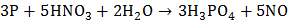 ;
;
с концентрированной азотной кислотой: 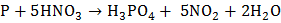 ;
;
с концентрированной серной кислотой: 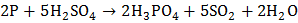 .
.
Лабораторная работа № 6
Химия элементов. Сера. Фосфор. Азот
Цель работы: Изучение свойств серы, фосфора, азота и их соединений.
Меры предосторожности при выполнении работы:






