Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода (для примера 1) приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия. Да, при добавлении соли, то есть фосфат-ионов (пример 2), равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что для того, чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH–] / [PO43–], уменьшится вдвое.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает. К этому же выводу придем из рассмотрения константы гидролиза.
Коллоидные растворы (золи) — ультрамикрогетерогенные дисперсные системы, размер частиц которых лежит в пределе от 1 до 100 нм (10 9 10 7см).
Способы получения. В основе химических методов образования коллоидных частиц часто лежит процесс полимеризации ионов и молекул за счет мости-ковых связей (гидроксильных, водородных, кислородных, фторидных и т. д.). Поэтому для управления процессом коллоидообразования важно знать закономерности процесса укрупнения частиц за счет химических «мостиков», в частности процессов оляции, оксоляции и др.
Механическое диспергирование
Большое значение имеют механические способы получения коллоидов. В громадных масштабах в промышленности осуществляется диспергирование твердых веществ до «коллоидных» размеров путем раздавливания, истирания и др. В природе этот эффект производят силы выветривания, процессы выщелачивания горных пород, а также движение ледников, действие приливов, отливов, штормов, бурь и др. В промышленности мелкий, «коллоидный», помол получают с помощью различного рода дробилок, жерновов, шаровых мельниц. Шаровая мельница представляет собой вращающийся полый цилиндр со свободно перемещающимися стальными или фарфоровыми шарами. С помощью шаровых мельниц, в частности, проводят размол цементного клинкера.
Частицы коллоидных размеров могут быть получены, кроме того, с помощью ультразвука, путем распыления металлов в вольтовой дуге, конденсацией в особых условиях паров высококипящих веществ, например металлов.
Применение коллоидов
Многие важнейшие химические - производства, такие, как цементная, нефтяная, бумажная, фармацевтическая промышленность, металлургия (гидрометаллургия и пирометаллургия), имеют дело прежде всего с коллоидными системами. С коллоидным состоянием вещества связано производство искусственных волокон, резины и др.
Уже говорилось о преобладании коллоидных систем (а не истинных растворов), в частности жидких коллоидных растворов, в животных и растительных организмах, минералах, почвах. Очень многие переходные и основные состояния неорганических соединений — также коллоидные.
Строение мицеллы
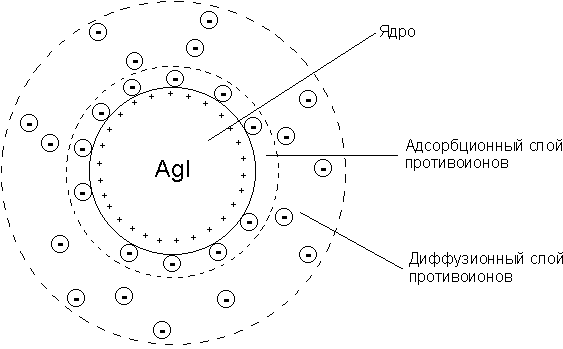 Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Потенциалопределяющими называются ионы, адсорбирующиеся на поверхности частички твердой фазы (агрегата) и придающие ей заряд. Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы.
Противоионы – ионы, группирующиеся вблизи ядра мицеллы.
Расположение противоионов в дисперсионной среде определяется двумя противоположными факторами: тепловым движением (диффузией) и электростатическим притяжением.
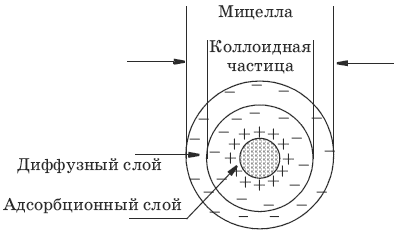 Противоионы, входящие в состав плотного адсорбционного слоя, называются «связанными» и вместе с ядром составляют коллоидную частицу, или гранулу. Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов.
Противоионы, входящие в состав плотного адсорбционного слоя, называются «связанными» и вместе с ядром составляют коллоидную частицу, или гранулу. Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов.
Противоионы, образущие диффузный слой, – «подвижные», или «свободные».
Коллоидная частица с окружающим ее диффузным слоем сольватированных про-тивоионов составляют мицеллу. В отличие от коллоидной частицы мицелла электронейтральна и не имеет строго определенных размеров.
 В мицелле с ионным стабилизатором на границе раздела фаз имеется ДЭС, возникает разность потенциалов между дисперсной фазой и дисперсионной средой – термодинамический потенциал ф (межфазный), который определяется свойствами данной дисперсной системы, а также зарядом и концентрацией потенциалопределяющих ионов, адсорбированных на твердой фазе.
В мицелле с ионным стабилизатором на границе раздела фаз имеется ДЭС, возникает разность потенциалов между дисперсной фазой и дисперсионной средой – термодинамический потенциал ф (межфазный), который определяется свойствами данной дисперсной системы, а также зарядом и концентрацией потенциалопределяющих ионов, адсорбированных на твердой фазе.
Перемещение заряженных коллоидных частиц в неподвижной жидкости к одному из электродов под действием внешнего электрического поля называется электрофорезом.
Поверхность, по которой происходит перемещение, называется поверхностью скольжения. Величина скачка потенциала на границе фаз, находящихся в движении относительно друг друга при электрофорезе и в броуновском движении, т. е. на поверхности скольжения, называется электрокинетическим или ζ-потенциалом (дзета-потенциал).
Агрегатная устойчивость золей не всегда обусловлена наличием специально введенного стабилизатора. Напр., в гидрозоле SiO2 (и нек-рых др.оксидов) двойной электрич. слой м. б. образован ионогенными продуктами хим. взаимодействия пов-сти агрегата, состоящего из частиц дисперсной фазы, с водой. При коагуляции или повышении концентрации (увеличении степени объемного заполнения системы частицами дисперсной фазы) золи превращаются в гели. При этом возможно образование периодических коллоидных структур (см. Структурообразование). Лиофильными золями являются мицеллярные р-ры разл. типов, мн. водные р-ры биополимеров, лиофобными - органо-и гидрозоли металлов, синтетич. латексы.Расплавы, содержащие коллоидно-дисперсную фазу, наз. пирозолями. При охлаждении пирозолей в результате застекловывания иликристаллизации дисперсионной среды возникают твердые золи. К ним относятся, напр., нек-рые минералы, в т. ч. драгоценные и полудрагоценные камни, цветные стекла (напр., рубиновые стекла), эмали, металлич. сплавы, дисперсноупрочненные материалы, стареющие сплавы на основе Al, Fe, Сu и др.
Кинетическая устойчивость. Частицы, находящиеся во взвешенном состоянии в газах, истинных растворах или коллоидных системах (в золях, суспензиях, эмульсиях), испытывают влияние двух противоположных процессов – осаждения под действием силы тяжести (седиментации) и диффузии. В результате этого через некоторый промежуток времени в системе устанавливается седиментационно-диффузионное равновесие, которое выражается в том, чтоконцентрация частиц в объеме системы падает в направлении от нижних слоев к верхним, если дисперсная фаза более плотная, чемдисперсионная среда, и, наоборот, от верхних слоев к нижним, если дисперсная фаза менее плотная. Предполагается, что это распределение подчиняется закону распределения Больцмана:
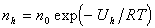 , (2.3.1.)
, (2.3.1.)
где n0 , nh - концентрация частиц на нулевом уровне и на высоте h от него, Uh - потенциальная энергия частиц на высоте h.
Потенциальную энергию частиц можно выразить как
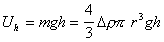 , (2.3.2)
, (2.3.2)
где m – масса частицы; r – ее радиус; Dr=r-r0, r, r0 - плотность вещества дисперсной фазы и дисперсионной среды; g- ускорение силы тяжести.
Подставляя (2.3.2) в уравнение (2.3.1), получаем
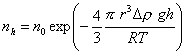 , (2.3.3)
, (2.3.3)
или
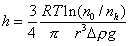 . (2.3.4)
. (2.3.4)
Уравнение (2.3.4) является математической формулировкой гипсометрического закона Лапласа. Для количественной характеристики кинетической устойчивости принята высота h1/2, на которой концентрация частиц изменится ровно в два раза, т.е. n1/2= n0/2.
Проверка применимости уравнения (2.3.4) к коллоидным системам была проведена Перреном, который экспериментально определял h1/2 и при известных значениях размеров частиц и их плотности рассчитывал число Авогадро и наблюдал хорошее совпадение с теоретическим значением.
Из уравнения (2.3.4) следует, что основными параметрами, определяющими кинетическую устойчивость дисперсных систем, является плотностьдисперсной фазы и размер частиц. Чем больше Dr, тем менее кинетически устойчива система и тем более она будет склонна к расслоению на две макрофазы. Увеличение размера частиц или капель эмульсии также способствует расслоению.
Коагуляция (от лат. coagulatio — свертывание, сгущение), также старение — объединение мелких частиц дисперсных систем в более крупные под влиянием сил сцепления с образованием коагуляционных структур.
Коагуляция — физико-химический процесс слипания коллоидных частиц.
Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию. Коагуляция — естественный, самопроизвольный процесс расслаивания коллоидного раствора на твёрдую фазу и дисперсионную среду. Таким образом дисперсная система стремится достигнуть состояния минимальной энергии.
Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил.
Скорость седиментации зависит от массы, размера, формы и плотности вещества частицы, вязкости и плотности среды, а также от ускорения силы тяжести и действующих на частиц центробежных сил.
В поле гравитационных сил седиментируют частицы грубодисперсных систем; в поле центробежных сил возможна седиментация коллоидных частиц и макромолекул (см.центрифугирование).
Седиментацию используют в промышленности при обогащении полезных ископаемых, различных продуктов химической и нефтехимической технологии, при водоочистке и др.
Седиментация в центрифугах и ультрацентрифугах, а также в гравитационном поле лежит в основе седиментационного анализа.
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← red uction- ox idation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.






