Протеолітичні ферменти використовуються як лікарські засоби (ацидинпепсин,
фестал, панкреатин) при порушенні секреції шлункового соку, при запаленні
підшлункової залози.
8.Утворення токсичних продуктів перетворення амінокислот у товстому кишечнику та їх знешкодження у печінці. Проба Квіка
Джерела аміаку:
пряме та непряме дезамінування амінокислот;
інактивація біогенних
амінів;
дезамінування пуринових і
піримідинових нуклеотидів;
гниття білків у кишечнику.
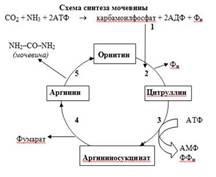
Орнітиновий цикл, або цикл Кребса –Хензелайта, або цикл синтезу сечовини – це головний процес знешкодженняаміаку у організмі людини. Він відбувається тільки у печінці(в мітохондріях і цитозолі) шляхом утворення нейтральної нетоксичної молекули сечовини, яка легко
проходить через мембрани,
транспортується по крові у нирки і
виводиться із сечею. Для біосинтезу сечовини необхідні аміак (потрапляє у печінку у складі глутаміну) і вугільна кислота (НСО3-).
Проба на синтез гіпурової кислоти (проба Квіка-Пітеля). Проба має значення у разі оцінки стану детоксикаційної функції печінки. Використовують бензойнокислий натрій перорально (розчиняють 6,0 г бензойнокислого натрію у 200 мл води), який після введення в печінці кон’югує з гліцином з утворенням гіпурової кислоти. Оцінку стану печінки проводять за кількістю гіпурової кислоти, що виводиться з сечею. Нормальна екскреція гіпурової кислоти становить не менше 3 г (сеча збирається протягом 4 годин). У разі ураження паренхіми печінки екскреція гіпурової кислоти знижується – проба стає позитивною. Проба Квіка дає позитивний результат у разі гострого та хронічного гепатиту, механічної жовтяниці, при цирозі та пухлинах печінки тощо.
9. Шляхи утворення та підтримання пулу вільних амінокислот в організмі. Загальні шляхи перетворення амінокислот в тканинах
Потік амінокислот, що виходить з амінокислотного пулу, включає анабо-
лічні і катаболічні шляхи перетворення вільних амінокислот і складається з таких
компонентів:
1. Використання амінокислот для синтезу білків організму. Для синтезу власних ферментних, структурних білків та фізіологічно активних сполук білкової і пептидної природи використовується близько 75-80 % амінокислот, що вивільняються при розщепленні тканинних білків, та амінокислот, які надходять із
кишечника.
2. Використання амінокислот, які не включені в анаболічні процеси, в катаболічних реакціях. При цьому молекули амінокислот розщеплюються з утворенням діоксиду вуглецю, води та кінцевих продуктів азотистого обміну. Певна частина безазотистого вуглецевого скелета амінокислот використовується для утворення глюкози (глюконеогенезу) та кетонових тіл (кетогенезу). Розщепленню підлягають усі амінокислоти, що не використовуються для синтезу білків або фізіологічно активних сполук незалежно від джерела походження, оскільки резерви білків у тваринних організмах не утворюються. Разом з тим, біоенергетичне значення катаболізму амінокислот у здорової людини незначне, порівняно з вуглеводами та ліпідами (близько 10 % від загальних енергетичних потреб), суттєво збільшуючись лише за умов голодування.
Першим етапом катаболізму вільних L-амінокислот є відщеплення α-аміногрупи в реакціях трансамінування та дезамінування. Деякі амінокислоти використовуються в реакціях декарбоксилювання з утворенням амінів гормональної та нейромедіаторної дії, які в подальшому також розщеплюються шляхом дезамінування.
10. Трансамінування амінокислот: механізм дії амінотрансфераз, біологічне значення
Трансамінування – це перенесення аміногрупи від амінокислоти на α-
 кетокислоту з наступним утворенням нової α-кетокислоти і нової амінокислоти без проміжного виділення аміаку. Цю реакцію каталізують амінотрансферази. Коферментом амінотрансфераз є піридоксальфосфат – активна форма вітаміна В6, котрий у якості посередника приймає аміногрупу від амінокислоти та перетворюється у піридоксамінфосфат. Амінотрансферази органоспецифічні: аланінамінотрансфераза локалізована переважно у печінці, аспартатамінотрансфераза - у серці. При пошкодженні цих органів ферменти
кетокислоту з наступним утворенням нової α-кетокислоти і нової амінокислоти без проміжного виділення аміаку. Цю реакцію каталізують амінотрансферази. Коферментом амінотрансфераз є піридоксальфосфат – активна форма вітаміна В6, котрий у якості посередника приймає аміногрупу від амінокислоти та перетворюється у піридоксамінфосфат. Амінотрансферази органоспецифічні: аланінамінотрансфераза локалізована переважно у печінці, аспартатамінотрансфераза - у серці. При пошкодженні цих органів ферменти
потрапляють у кров. Визначення їхньої активності у сироватці крові є дуже важливим методом для виявлення та контролю за перебігом гострого гепатиту (АлАт) та інфаркту міокарда (АсАт). Активність цих індикаторних ферментів підвищується при даних захворюваннях у 20-30 разів.
Значення реакцій трансамінування:
колекторна функція – збирання аміногрупп від різних амінокислот у вигляді глутамінової кислоти;
синтез замінних амінокислот;
перерозподіл амінного азоту у тканинах;
початковий етап катаболізму амінокислот, перша стадія непрямого дезамінування;
завдяки реакціям трансамінування вуглецевий скелет амінокислот може включатися в інші види обміну
речовин
11. Дезамінування амінокислот. Механізм непрямого дезамінування. Біологічна роль глутаматдегідрогенази у печінці та нейронах головного мозку
Дезамінування - це процес відщеплення α-аміногрупи від амінокислоти у вигляді аміаку. Дезамінуванню підлягають усі
амінокислоти, крім лізину. 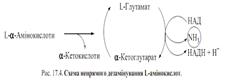 Аминокислоти, котрі не здатні дезамінуватися прямо, підлягають непрямому дезамінуванню або трансдезамінуванню, яке складається з 2 етапів:1 –трансамінування амінокислоти з ά-кетоглутаровою кислотою, внаслідок чого утворюється глутамінова кислота,
Аминокислоти, котрі не здатні дезамінуватися прямо, підлягають непрямому дезамінуванню або трансдезамінуванню, яке складається з 2 етапів:1 –трансамінування амінокислоти з ά-кетоглутаровою кислотою, внаслідок чого утворюється глутамінова кислота,
2 – пряме окиснювальне дезамінування глутамінової кислоти з наступним
утвореннім вільного аміаку.
Глутаматдегідрогеназа, каталізуюча другий етап трансамінування, - регуляторний
алостеричний фермент. Її інгібує НАДН2. Від активності глутаматдегідрогенази
залежить швидкість непрямого дезамінування амінокислот і утворення аміаку.
12. Альфа-декарбоксилювання амінокислот. Функція біогенних амінів в організмі. Знешкодження біогенних амінів. Антигістамінні фармацевтичні препарати
Декарбоксилювання – відщеплення α-карбоксильної групи з утворенням СО2 і біогенних амінів – фізіологічно активних речовин (гормонів, нейромедиаторів тощо). У тканинах людини і вищих тварин деякі амінокислоти – гістидин, тирозин, триптофан та інші – декарбоксилюються, перетворюючись в аміни за участю декарбоксилази. З цих амінокислот утворюються гістамін, тирамін, триптамін, а також адреналін і норадреналін, нейрогуморальний агент серотонін. При декарбоксилюванні гістидину утворюється гістамін:
Знешкодження біогенних амінів:
1.Окисненя (з дезамінуванням) під дією моноамінооксидаз (МАО): 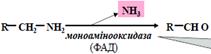
2. Метилювання за участю SAM – для гістаміну, адреналіну, норадреналіну: 
Антигістамінні препарати — група лікарських засобів, що гальмують дію гістаміну, здійснюючи конкурентну блокаду його рецепторів в організмі. В наш час виділяють три групи препаратів: H1-блокатори — використовують в терапії алергічних захворювань. H2-блокатори — використовують при лікуванні захворювань шлунка (сприяють зниженню шлункової секреції). H3-блокатори — використовують в терапії неврологічних захворювань.
13. Шляхи перетворення безнітрогенних залишків амінокислот. Глюкогенні та кетогенні амінокислоти
Інтенсивний розпад амінокислот призводить до утворення ацетил-КоА, а звідси – до синтезу кетонових тіл у печінці. Тому амінокислоти поділяють на глюкогенні (утворюють глюкозу в процесі глюконеогенезу) та кетогенні (використовуються для синтезу кетонових тіл). Такий поділ є умовним, оскільки більшість амінокислот – це і глюкогенні (аланін, гліцин фенілаланін, глутамат тощо), і кетогенні (фенілаланін, тирозин, лейцин, цистеїн, серин)
14. Шляхи утворення та знешкодження амоніаку в організмі. Механізм утворення сечовини (орнітиновий цикл)
Джерела аміаку:
пряме та непряме
дезамінування амінокислот;
інактивація біогенних
амінів;
дезамінування пуринових і
піримідинових нуклеотидів;
гниття білків у кишечнику.
Шляхи знешкодження аміаку:
1. Утворення транспортних форм аміаку. Головною транспортною формою аміаку є глутамін, який легко проходить через клітинні мембрани, тому що він є нейтральною сполукою: 
Із кишечника та м’язів аміак виводиться у вигляді аланіну 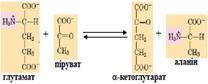
2. Біосинтез сечовини – орнітиновий цикл.
Орнітиновий цикл, або цикл Кребса –Хензелайта, або цикл синтезу сечовини – це головний процес знешкодженняаміаку у організмі людини. Він відбувається тільки у печінці(в мітохондріях і цитозолі) шляхом утворення нейтральної нетоксичної молекули сечовини, яка легко
проходить через мембрани,
транспортується по крові у нирки і
виводиться із сечею. Для біосинтезу сечовини необхідні аміак (потрапляє у печінку у складі глутаміну) і вугільна кислота (НСО3-).
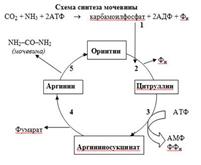 3. Синтез солей амонію у нирках
3. Синтез солей амонію у нирках
Глутамін, який транспортує аміак у нирки, розщеплюється глутаміназою, котра
активується при ацидозі, а аміак, що утворився, використовується для нейтралізації кислих продуктів з наступним утворенням солей амонію (0,5 г на добу):  15. Особливості обміну окремих амінокислот: фенілаланіну, тирозину, триптофану, гліцину, метіоніну
15. Особливості обміну окремих амінокислот: фенілаланіну, тирозину, триптофану, гліцину, метіоніну
Фенілаланін – незамінна амінокислота, тирозин – умовно замінна, синтезується
тільки із фенілаланіну. Катаболізм цих амінокислот відбувається у печінці. У процесі катаболізму утворюються фумарат, який може використовуватися у глюконеогенезі, та ацетоацетат -кетонове тіло. Обидві ароматичні амінокислоти є
кетоглікогенними. 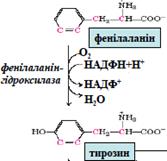
Фенілкетонурія – фенілаланін накопичується у крові, з сечею виводяться феніл кетони у великих кількостях, котрі утворюються з надлишкового фенілаланіну. Захворювання
характеризується затримкою розумового та
фізичного розвитку. Тирозиноз - відсутність або дефіцит тирозинамінотрансферази призводить до розвитку тирозинемії ІІ типу, яка характеризується гіпертирозинемією і тирозинурією. Клінічні прояви можуть включати ерозії і бляшки рогівки, ураження шкіри, сповільнення розумового розвитку. Триптофан є незамінною амінокислотою і попередником у синтезі серотоніну і нікотинаміду. Основний, або окисний шлях, яким метаболізується близько 95 % амінокислоти, починається з його окислення ферментом триптофандиоксигеназою (піролазою) до формілкінуреніну. Серотоніновий шлях метаболізму триптофану починається з його гідроксилювання до 5 гідрокситриптофану ферментом триптофангідроксилазою.Декарбоксилювання 5-гідрокситриптофану ПАЛФ-залежною декарбоксилазою призводить до утворення серотоніну. Серотонін виконує функції нейротрансміттера в мозку, його дефіцит є одним з факторів формування депресивних станів і тяжких форм мігрені. Хвороба Хартнупа – спадкові розлади всмоктування в кишечнику і реабсорбції в ниркових канальцях триптофану та інших нейтральних амінокислот. Гліцин – замінна глюкогенна амінокислота, бере участь в численних синтетичних шляхах, а також може окислюватися з виділенням енергії. Синтезується гліцин за допомогою ферменту серингідроксиметилтрансферази з іншої замінної амінокислоти – серину. Гліцин і серин є джерелами одновуглецевих залишків, які переносяться за допомогою тетрагідрофолієвої кислоти N5,N10(- СН2 -)ТГФК, і використовуються у унікальних реакціях синтезів метіоніну, пуринових нуклеотидів, тіміділату... Метіонін – незамінна амінокислота, котра у вигляді метіоніл-тРНК приймає участь у
ініціації біосинтеза білків. Особлива роль метіоніну полягає у тому, що він у вигляді
своєї активної форми S-аденозилметіонину (SAM) є донором метильних груп для
утворення різноманітних сполук (R-СН3) у реакціях трансметилювання (реакція 2). До цих сполук належать фосфатидилхолін, креатин, адреналін, карнітин тощо.
16. Патології обміну амінокислот та їх корекція фармацевтичними засобами. Амінокислоти як фармпрепарати
Гіпероксалурія - зазворювання при якому утворюється велика кількість оксалату. Оскільки кальцієва сіль оксалату погано розчинна у воді, її кристали відкладаються в нирках, викликаючи нефролітіаз і нефрокальциноз. Креатинурія – це посилене виділення креатину з сечею, зустрічається при лихоманці, голодуванні, цукровому діабеті, травматичних пошкодженнях м’язів, м’язовій дистрофії і гіпертиреоїдизмі. Цистинурія – це спадкове захворювання, що характеризується порушенням реабсорбції в ниркових канальцях цистину, лізину, орнітину і аргініну. Оскільки цистин нерозчинний у воді, клінічно цистинурія проявляється сечокам’яною хворобою. Хвороба кленового сиропу – спадкове захворювання, зумовлене порушенням окисного декарбоксилювання розгалужених a-кетокислот, що виникає внаслідок дефекту гену, який відповідає за синтез дегідрогенази розгалуженого ланцюга. В крові і внутрішніх органах збільшується вміст валіну, лейцину та ізолейцину і відповідних розгалужених a-кетокислот. Алкаптонурія – рідкісне спадкове метаболічне захворювання, що розвивається внаслідок генетичного дефекту гомогентизатоксидази. Вміст гомогентизинової кислоти збільшується в крові і вона виділяється з сечею. Тирозиноз - відсутність або дефіцит тирозинамінотрансферази призводить до розвитку тирозинемії ІІ типу, яка характеризується гіпертирозинемією і тирозинурією. Клінічні прояви можуть включати ерозії і бляшки рогівки, ураження шкіри, сповільнення розумового розвитку. Альбінізм - генетично детермінована відсутність або недостатність фермента тирозинази призводить до зниження продукції або відсутності меланіну в шкірі, волоссі, очах. Зниження вмісту пігменту в шкірі зумовлює високу чутливість до сонячного світла, підвищується ризик розвитку раку шкіри і сонячних опіків. Хвороба Хартнупа – спадкові розлади всмоктування в кишечнику і реабсорбції в ниркових канальцях триптофану та інших нейтральних амінокислот. Виникає дефіцит триптофану в організмі, що призводить до недостатнього синтезу нікотинової кислоти і серотоніну. Хвороба проявляється пеллагроподібними змінами шкіри, мозочковою атаксією, порушенням розумового розвитку, аміноацидурією, індиканурією. Гістидинемія - спадкове захворювання, зумовлене дефіцитом гістидази. В крові і сечі підвищується вміст гістидину, зрідка можуть спостерігатися порушення розумового розвитку. Обмеження гістидину в дієті нормалізує біохімічні аномалії.
Як фармпрепарати застостовуються такі амінокислоти та їх похідні: глутамінова кислота як ефективний засіб, що стимулює окислювальні процеси в тканині мозку, а також зв'язує утворений аміак;
препарати ГАМК, що є продуктом декарбокси лювання глутамінової кислоти і виконує роль нейромедіатора центральної нервової системи (аміналон, пантогам).
Гідрохлорид гістидину застосовується для лікування гепатитів, виразкової хвороби шлунка та дванадцятипалої кишки. Широко використовуються такі препарати як панангін - калієва та магнієва сіль аспарагінової кислоти, метіонін, який є донором метильних груп і бере участь у синтезі адреналіну, ряду ферментів, Останніми роками був отриманий лікарський препарат на основі амінокислоти гліцину, який сприяє синтезу лецитину, запобігаючи таким чином утворенню стеросклеротичних бляшок.
17. Клініко-діагностичне значення дослідження активностей аланінамінотрансферази та аспартатамінотрансферази у плазмі крові
Трансамінази є внутрішньоклітинними ферментами. Зростання їх концентрації в крові свідчить про синдром цитолізу – порушення цілісності клітин. У цитоплазмі клітин концентрація АлАТ переважає над концентрацією АсАТ, але в мітохондріях є специфічна ізоформа АсАТ. Тому при захворюваннях запального типу у сироватці крові в більшій мірі зростає активність АлАТ, а при захворюваннях некротичного типу переважає активність АсАТ. Активність АсАТ у крові зростає через 4-6 год. після інфаркту міокарда і звичайно повертається до норми на 3-7 день. При стенокардії АсАТ залишається в нормі. Найвища активність АлАТ характерна для захворювань печінки – особливо в інкубаційному періоді інфекційного гепатиту. Зниження нормальних показників амінотрансфераз у плазмі може бути при недостатності вітаміну В6, а також при нирковій недостатності.
18. Клініко-діагностичне значення дослідження вмісту залишкового азоту та сечовини у сироватці крові
В нормі вміст залишкового азоту дорівнює 14–28 ммоль/л, або 0,2-0,4 г/л. Підвищення залишкового азоту крові називається азотемією. Азотемія може бути двох видів: абсолютною і відносною. Зниження вмісту залишкового азоту спостерігають при недостатньому харчуванні та іноді при вагітності. Клінічне значення дослідження сечовини В процесі дезамінування амінокислот, пуринових і піримідинових основ, біогенних амінів та інших азотвмісних речовин утворюється токсичний аміак (NH3), основним шляхом знешкодження якого є синтез сечовини в печінці. Виділяється сечовина з організму нирками. В нормі вміст сечовини в сироватці крові складає 2,7–8,3 ммоль/л, або 20–50 мг/дл. Підвищення концентрації в крові сечовини спостерігається при всіх видах азотемій, особливо ретенційних, і є однією з головних ознак порушення функції нирок. Також при серцево-судинній декомпенсації, зневодненні організму внаслідок нестримного блювання, профузних проносів, Зниження концентрації сечовини в крові може бути відносним за рахунок розведення при гіпергідратаціях організму. Зростання екскреції сечовини із сечею спостерігається при дієті з підвищеним вмістом білків, у хворих на гіпертиреоз, у післяопераційному періоді, при продукційній азотемії, у хворих з анеміями, гарячкою. Знижується екскреція сечовини в здорових дітей під час активного росту, у вагітних жінок, при білковому голодуванні, захворюваннях печінки, захворюваннях нирок і нирковій недостатності будь-якого походження.
19. Гемоглобін: структура, властивості та функція в організмі
Гемоглобін (Hb) складається з гема
(небілкова частина) та білка глобіну, який
представлений чотирма поліпептидними
ланцюгами, кожний з яких просторово
оточує молекулу гема. Залежно від
комбінації типів поліпептидних ланцюгів
розрізняють види гемоглобіну:
HbА1 – складається з 2α- та 2β-ланцюгів;
HbА2 - з 2α- и 2σ-ланцюгів (2,5%);
Hb F - з 2α- и 2γ-ланцюгів.
Гем складається з 4 пирольних кілець, що містять метильні (М) та вінільні (В) замісники. Азотовмісні кільця зв’язані метіленовими містками, утворюючи порфіринове кільце, а атоми азоту пов'язані із залізом: два азоти – ковалентними зв'язками, інші два азоти - координаційними зв'язками. Крім того, атом заліза пов'язаний з амінокислотою гістидином білка глобіна, а також має здатність до зв’язування лігандів: кисню або вуглекислого газу. Залізо в гемоглобіні двовалентно (Fе2+). Нормальним вмістом гемоглобіну в крові людини вважається: у чоловіків 130—170 г/л, у жінок 120—150 г/л; у дітей — 120—140 г/л. Гемоглобін має дві основні фізіологічні функції:
1) дихальну – бере участь у транспорті кисню та вуглекислого газу;
2) забезпечує сталість рН
20. Патологічні похідні гемоглобіну, причини їх утворення
Гемоглобінопатії є наслідком зміни кількісного або якісно-го амінокислотного складу поліпептидних ланцюгів гемогло-біну, тому вони належать до якісних гемоглобінопатій. HbS – гемоглобін, в якому в 6-му положенні β-ланцюга глутамінова кислота замінена на валін. Валін призводить до зниження розчинності гемоглобінуУ результаті спостерігаються підвищення в’язкості крові, зменшення швидкості кровотоку, HbC – гемоглобін, в якому в 6-му положенні β-ланцюга глу-тамінова кислота замінена на лізин. Цей гемоглобін також кристалізується в еритроцитах, які гемолізують, результатом чого є розвиток анемії. HbD – гемоглобін, в 121-му положенні бета-ланцюга якого глутамінова кислота замінена на глутамін. При високому вмісті такого аномального гемоглобіну розвивається легка форма гемолітичної анемії. HbЕ – гемоглобін, в 26-му положенні β-ланцюга якого глу-тамінова кислота замінена на лізин. Супроводжується розвитком мікроцитарної гіпохромної анемії. HbM – існує група гемоглобінів, у яких структурний дефект (амінокислотна заміна) перешкоджає відновленню метгемоглобіну до гемоглобіну. Спостерігається накопичення метгемоглобіну.
21. Розпад гемоглобіну в тканинах. Утворення жовчних пігментів: проміжні метаболіти, кінцеві продукти
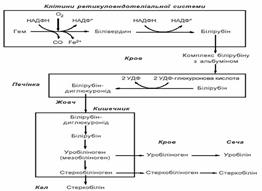

ЖОВЧНІ ПІГМЕНТИ — забарвлені нітрогенвмісні продукти розпаду гемоглобіну, що входять до складу жовчі та у невеликих кількостях наявні у крові й тканинах. Утворюються в печінці, виділяються з жовчю у вигляді білірубіну і білівердину. Виводяться Ж.п. в основному з калом, частково із сечею. Підвищений вміст у крові призводить до розвитку жовтяниці. У печінці білірубін шляхом кон’югації перетворюється переважно на білірубіндиглюкуронід. У нормі — один із проміжних продуктів розпаду гемоглобіну, який відбувається в макрофагах селезінки, печінки і кісткового мозку. Білірубін утворюється з білівердину шляхом ферментативного відновлення.
22. Білірубін і його фракції: клінічне значення для діагностики порушень функцій печінки. Форми жовтяниць
У крові білірубін присутній у 2 фракціях, які називаються непрямий білірубін (вільний або незв’язаний) і прямий білірубін (пов’язаний або кон’югування), які в сумі складають загальний білірубін. Непрямий білірубін – утворюється при розпаді гемоглобіну, не розчинний у воді, але добре розчинний у жирах, через це дуже токсичний. Легко проникає в клітини, порушуючи їх нормальне функціонування. Прямий білірубін – утворюється в печінці після зв’язування з глюкуроновою кислотою (тому він також називається зв’язаний або кон’югованих). Прямий білірубін розчиняється у воді, менш токсичний, і надалі виводиться з організму з жовчю. Норма білірубіну в сироватці крові не перевищує 21 мкмоль/л. Коли рівень сироваткового білірубіну підвищується (гіпербілірубінемія), розвивається жовтяниця через відкладання білірубіну в шкірі і слизових оболонках.Розрізняють такі види жовтяниці згідно механізму і місця виникнення: надпечінкова (найчастіше вона носить гемолітичний характер — у крові зростає рівень непрямого білірубіну), печінкова (паренхіматозна; в крові зростає рівень обох фракцій білірубіну, однак рівень прямої фракції значно перевищує рівень непрямої), холестатична (підпечінкова, обтураційна, застаріле — механічна; підвищується, зазвичай, рівень прямої фракції білірубіну). Розрізняють:
Спадкові жовтяниці (синдром Криглера-Найяра, хвороба Жильбера, синдром Дабіна-Джонсона, сімейна гіпербілірубінемія новонароджених);
Набуті жовтяниці.
23. Схема біосинтезу гемоглобіну та фактори його регуляції
Біосинтез глобіну здійснюється в еритроїдних клітинах кісткового мозку шляхом синхронної продукції гема і глобінових ланцюгів і їх поєднання з утворенням закінченою молекули. З 4 молекул порфобіліногена утворюється спочатку уропорфіріноген, потім копропорфіріноген за участю ферменту декарбоксилази уропорфіріноген. З копропорфіріногена під впливом декарбоксилази копропорфіріногена синтезується протопорфирин, який, з'єднуючись із залізом, утворює гем.
З'єднання протопорфирина з залізомздійснює фермент гемсінтетази.
24. Спадкові порушення синтезу гемоглобіну. Аномальні форми гемоглобіну
Таласемії (греч. thalassa - море і гемо...) – це найбільш поширені спадкові захворювання людини. Залежно від того, порушення синтезу яких ланцюгів гемоглобіну спостерігається при цій патології, таласемії прийнято поділяти на дві групи: α- та β-таласемії. Альфа-таласемія обумовлена порушенням синтезу α-ланцюгів Hb (внаслідок делеції або інактивації одного з чотирьох генів альфа-ланцюгів глобіну). Бета-таласемія розвивається внаслідок порушення синтезу β-ланцюгів. Аномальні гемоглобіни найчастіше спостерігаються у жителів країн узбережжя Середземномор’я, Центральної та Східної Африки, Ближнього та Середнього Сходу, Південної та Південно-Східної АзіТаласемія – спадкове захворювання, при якому спостерігається делеція генів, які кодують синтез ланцюгів гемоглобіну. Тип наслідування –аутосомно-домінантний.
25. Нуклеопротеїни: характеристика і функції в організмі
Нуклеопротеїни — складні білки, комплекси нуклеїнових кислот з білкамиЗалежно від типу нуклеїнової кислоти, нуклеопротеїни поділяються на дезоксирибонуклеопротеїни та рибонуклеопротеїниСтійкість нуклеопротеїнових комплексів забезпечується нековалентною взаємодією.Нуклеопротеїни дисоціюють на білки і нуклеїнові кислоти при дії агентів, що руйнують або ослабляють нековалентні зв'язки:
1) підвищені концентрації солей або сечовини, що збільшують іонну силу розчину;
2) іоногенні поверхнево-активні речовини;
3) деякі полярні органічні сполуки (формамід і диметилформамід, фенол тощо).
Дезоксирибонуклеопротеїни
Хроматин — комплекс ДНК з гістонами в клітинах еукаріот. Окремим важливим класом дезоксирибонуклеопротеїнів є вірусні нуклеопротеїни.
Рибонуклеопротеїни
У клітинах в основному містяться такі типи рибонуклеопротеїнів (РНП):
1) Нуклеопротеїнові комплекси рибосомних РНП (рРНП) — субодиниці рибосом — органел, на яких відбувається трансляція мРНК. Рибосоми є агрегатами з двох різних рРНП-субодиниць.
2) Малі ядерні рибонуклеопротеїни (мяРНП) — нуклеопротеїнові комплекси малих ядерних РНК.
3) Нуклеопротеїнові комплекси мРНК — матричні рибонуклеопротеїни (мРНП).
Нуклеопротеїни відіграють дуже важливу біологічну роль. З ними пов'язані процеси синтезу білків, які лежать в основі таких явищ, як поділ, мінливість і формування спадкових ознак організму. Ці біологічні функції нуклеопротеїнів властиві як для цілої молекули, так і для нуклеїнових кислот, котрі входять до їхнього складу. Білкова частина нуклеопротеїнів представлена переважно гісто-нами, протамінами і невеликою кількістю альбумінів, глобулінів та інших білків. Гістони розподіляються на 5 класів, які відрізняються один від одного за розмірами, амінокислотним складом і величиною заряду. Гістони виконують регуляторну функцію, яка полягає в механізмах транскрипції і реплікації, у здатності блокувати передачу генетичної інформації від ДНК до РНК.
26. Нуклеїнові кислоти: ДНК, РНК. Рівні структурної організації
Нуклеїнові кислоти – це високомолекулярні сполуки, що складаються із мономерних одиниць – нуклеотидів, і тому їх також називають полінуклеотидами Природні нуклеїнові кислоти — ДНК і РНК — виконують у всіх живих організмах роль передачі і експресії генетичної інформації. Вперше їх виявлено в ядрі клітини, Молекула нуклеотиду складається із залишків(азотистої основи) (пентози) і фосфатної кислоти. Розрізняють два типи нуклеїнових кислот: дезоксирибонуклеїнову (ДНК) і рибонуклеїнову (РНК). До складу ДНК входить залишок пентози дезоксирибози, до складу РНК — рибози.
Структура
Нуклеїновим кислотам, як і білкам, притаманна первинна структура — певна послідовність розташування нуклеотидів, а також складніша вторинна і третинна структури, які формуються за допомогою водневих зв'язків, електростатичним та іншим взаємодіям.Нуклеїнові кислоти є біополімерами, мономерами яких є нуклеотиди. Нуклеотиди є складними ефірами нуклеозиду і фосфорної кислоти і з'єднуються через залишок фосфорної кислоти (фосфодіестерний зв'язок).
ДНК і РНК
ДНК — дезоксирибонуклеїнова кислота. Цукор — дезоксирибоза, азотисті основи: пуринові — гуанін (G), аденін (A), піримідинові — тимін (T) і цитозин (C). ДНК часто складається з двох полінуклеотидних ланцюжків, направлених антипаралельно.
РНК — рибонуклеїнова кислота. Цукор — рибоза, азотисті основи: пуринові — гуанін (G), аденін (A), піримідинові урацил (U) і цитозин (C). Структура полінуклеотидного ланцюжка аналогічна такій в ДНК, дволанцюжкові РНК зустрічаються тільки у вірусів. Через особливість рибози, молекули РНК часто мають різні вторинні і третинні структури, утворюючи комплементарні ділянки між різними ланцюжками.
Первинна структура молекули ДНК
Під первинною структурою нуклеїнових кислот увазі послідовність розташування нуклеотидів в полінуклеотидних ланцюга ДНК. Нуклеотиди зв’язуються між собою за допомогою фосфодіефірних зв’язків,
Молекула ДНК: вторинна структура
Уотсон і Крик спроектували модель подвійної спіралі дезоксирибонуклеїнової кислоти. Згідно даної моделі дві полінуклеотидних ланцюга обвивають один одного, при цьому утворюється своєрідна спіраль.
Молекула ДНК: третинна структура Лінійна ДНК у клітині має форму витягнутої молекули, вона упакована в компактну структуру і займає всього 1/5 об’єму клітини.
27. Мононуклеозидтрифосфати, циклічні мононуклеотиди: структура та їх функції в клітині. Застосування похідних нуклеозидів та нуклеотидів в якості ліків
Нуклеотиди – це фосфорні ефіри нуклеозидів. Зв'язок утворюється за рахунок взаємодії фосфату з гідроксилом у положенні С-5' пентози. При гідролізі нуклеїнових кислот можуть утворюватися і нуклеозид-3'-монофосфати.
 Структура нуклеозид-3'-монофосфату
Структура нуклеозид-3'-монофосфату
 Функції:
Функції:
1)Входять в склад нуклеїнових кислот
2)Утворюють макроергічні сполуки
3)Циклічні мононуклеотиди є месенджерами передачі гормональних сигналів в клітину
4)Є позитивними і негативними регуляторами метаболічних реакцій в клітині
Циклічні аденозинмонофосфат (цАМФ) і гуанозинмонофосфат (цГМФ) відіграють дуже важливу роль в обміні речовин, через них реалізується регуляторна роль ряду гормонів. цАМФ і цГМФ утворюються із АТФ і ГТФ під дією ферментів аденілатциклази і гуанілатциклази. Система АТФ-АДФ-АМФ відіграє особливу роль у біоенергетиці, у всіх живих організмах АТФ виступає як депо для зберігання і перенесення енергії. Аналогічно до АТФ, інші нуклеозидтрифосфати також містять два високоенергетичні зв'язки між фосфатними залишками і використовуються в обміні речовин. Арабінозид аденіну виявляє антивірусну активність. За будовою він близький до природного нуклеозиду. 5-фторурацил виступає в ролі антагоніста урацилу і тиміну, а 6-меркаптопурин -аденіну. Конкуруючи з метаболітами, вони порушують синтез нуклеїнових кислот в організмі, що знайшло використання при лікуванні пухлинних захворювань.
28. Перетворення нуклеопротеїнів у шлунково-кишковому тракті та тканинах
У процесі травлення нуклеїнові кислоти їжі розпадаються до нуклеотидів і нуклеозидів, які всмоктуються клітинами слизової кишечника. Але наявність їх у їжі не обов'язкова, оскільки майже всі клітини організму можуть синтезувати нуклеотиди. Нуклеїнові кислоти гідролізуються під дією нуклеаз підшлункового соку. Розрізняють рибонуклеази (РНКази) і дезоксирибонуклеази (ДНКази). Продуктами гідролізу є оліго- і мононуклеотиди. Фосфодіестерази слизової кишечника розщеплюють олігонуклеотиди до мононуклеотидів. Вільні нуклеотиди гідролізуються кишковими фосфатазами до нуклеозидів і фосфорної кислоти. Нуклеозиди абсорбуються і в клітинах слизової кишечника можуть розщеплюватись до вільних азотистих основ.Тканинні нуклеази, нуклеотидази, нуклеозидази і нуклеозидфосфорилази поетапно розщеплюють клітині нуклеїнові кислоти до вільних азотистих основ, які перетворюються далі у кінцеві продукти – сечову кислоту із пуринів та сечовину і бета-амінокислоти із піримідинів.
29. Обмін пуринових нуклеотидів, його порушення та корекція фармацевтичними засобами
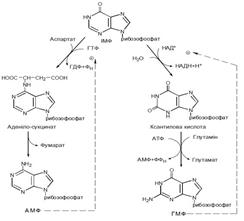
Біосинтез пуринових нуклеотидів регулюється за принципом зворотного зв'язку. Регуляторною є рання реакція взаємодії 5-фосфорибозил-1-дифосфату з глутаміном. Активність ферменту алостерично гальмується кінцевими продуктами ланцюга реакій — ІМФ, АМФ і ГМФ. Другий регуляторний механізм діє на пізніших стадіях. АМФ гальмує реакцію синтезу із ІМФ аденіло-сукцинату, а ГМФ — ксантилової кислоти.
КАТАБОЛІЗМ ПУРИНОВИХ НУКЛЕОТИДІВ
Розпад пуринових нуклеотидів включає реакції відщеплення фосфатного залишку, рибози й аміногрупи у вигляді аміаку, що призводить до утворення із АМФ гіпоксантину, а із ГМФ — ксантину. Фермент ксантиноксидаза каталізує окиснення гіпоксантину в ксантин і ксантину в сечову кислоту. Сечова кислота є кінцевим продуктом розпаду пуринів у людей (а також приматів, птахів, змій, ящірок) і виводиться з організму.
Подагра – це спадкова хвороба. У хворих на подагру виявлено підвищення активності фосфорибозил-пірофосфат-синтетази, недостатність глюкозо-6-фосфатази, гіпоксантин-гуанін-фосфорибозилтрансферази (ГГФТ). Хвороба супроводжується гострим запаленням суглобів, найчастіше дрібних. Надлишок уратів зумовлює утворення каменів у нирках. Утворенню кристаликів сечової кислоти і відкладанню їх у тканинах сприяють зниження місцевого рН та травми. Алопуринол – основний урикодепресивний препарат для зниження рівня сечової кислоти при хронічній гіперурикемії. Цей препарат структурний аналог гіпоксантину, що є конкурентним інгібітором ксантиноксидази.
Синдром Леш–Ніхана обумовлений порушенням метаболізму пуринових основ в результаті генетично обумовленого дефіциту ферменту гіпоксантин-гуанінфосфорибозілтрансферази (ГФРТ). Для дітей з таким генетичним дефектом характерні не тільки подагричні симптоми, але й розумова відсталість, агресивність, часто спрямована на самого себе.
30. Обмін піримідинових нуклеотидів та його порушення
Піримідинові нуклеотиди, як і пуринові, синтезуються із простих сполук, а саме з СО2, глутаміну, аспартату і рибозо-5-фосфату. Але у цьому випадку спочатку утворюється шестичленне піримідинове 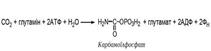 кільце, а потім до нього приєднується рибозофосфат.
кільце, а потім до нього приєднується рибозофосфат.
У першій реакції шляху під дією карбамоїлфосфатсинтетази II із амідної групи глутаміну, СО2 і АТФ утворюється карбамоїлфосфат. Фермент локалізований у цитоплазмі клітин різних тканин. Карбамоїлфосфатсинтетаза II є регуляторним ферментом на метаболічному шляху синтезу піримідинових нуклеотидів і активність її гальмується кінцевим продуктом — уридинмонофосфатом (УМФ).
Регуляція синтезу піримідинових нуклеотидів Контроль швидкості біосинтезу піримідинових нуклеотидів забезпечується на рівні двох регуляторних ферментів:
1) карбамоїлфосфатсинтетази, яка забезпечує постачання біосинтетичного шляху одним із перших субстратів
2) аспартаткарбамоїлтрансферази, яка каталізує синтез уреїдоянтарної кислоти; алостеричним інгібітором ферменту є ЦТФ, активатором — АТФ.
КАТАБОЛІЗМ ПІРИМІДИНОВИХ НУКЛЕОТИДІВ
Розпад піримідинових основ, на відміну від пуринових, супроводжується розкриттям кільця. Аміак і СО2 використовуються для синтезу сечовини. Бета-аланін може включатись у структуру коферменту А. Гама-аміноізомасляна кислота перетворюється через метилмалонову кислоту в сукциніл-КоА.
31 Реплікація, її механізм і біологічне значення. Репарація ДНК
Реплікація — синтез дочірніх молекул ДНК, ідентичних материнській ДНК
Гіпотези реплікації ДНК
Консервативний механізм — при такому способі розкручування спіралі не відбувається, існуюча подвійна спіраль є матрицею для синтезу двох нових ланцюгів. Нова спіраль будується повністю з нового матеріалу, існуюча спіраль залишається незмінною.
Напівконсервативний механізм — існуюча спіраль розкручується, на кожному полінуклеотидному ланцюзі комплементарно будується новий. Таким чином нова подвійна спіраль є «гібридом» старого та нового ланцюгів
Дисперсивний механізм — існуюча спіраль розривається на кожному півоберті шляхом багаторазової фрагментації. Кожний полінуклеотид ний ланцюг складається з відрізків старого та нового матеріалу, які чергуються. Головними ферментами є ДНК-залежні ДНК-полімерази. Клітини у прокаріотів і еукаріотів містять декілька ДНК-полімераз. Для реплікації необхідні материнська дволанцюгова ДНК, чотири дезоксирибонуклеозидтрифосфати (дАТФ, дГ ТФ, дТТФ, дІДТФ), іони Мд2+, Zn2+, ферменти і білкові фактори реплісоми. Синтез нових ланцюгів відбувається тільки в напрямку 5'—>3', причому антипаралельно до матричного ланцюга. Один ланцюг (ведучий) синтезується безперервно в напрямку руху реплікативної вилки, а другий (відстаючий) переривчасто з утворенням фрагментів завдовжки близько 2000 нуклеотидів у прокаріотів і значно коротших в еукаріотів. Ці так звані фрагменти Оказакі (японський учений, який вперше їх відкрив) синтезуються у напрямку, протилежному руху реплікативної вилки. Головний фермент, що каталізує реплікацію обох ланцюгів у прокаріотів — ДНК-полімераза III, а в еукаріотів — ДНК-полімераза а. Інші ДНК-полімерази відіграють допоміжну роль у реплікації. Таким чином, синтез фрагмента Оказакі починається з праймера, який після завершення синтезу фрагмента видаляється,Два нові ланцюги, з'єднані зі своїми комплементарними ланцюгами, утворюють дві дочірні подвійні спіралі, кожна з яких містить один материнський і один новосинтезований ланцюг. Репарація — ферментативне видалення і повторний синтез ділянок ДНК, що отримали пошкодження під дією фізичних та хімічних агентів.
32. Загальні уявлення про мутації та мутагени
У біології, мута́ції — зміни генетичного матеріалу (звичайно ДНК або РНК). Мутації можуть бути викликані помилками копіювання генетичного матеріалу протягом поділу клітини, опроміненням жорсткою радіацією, хімічними речовинами (мутагенами), вірусами або можуть відбуватися свідомо під клітинним контролем протягом таких процесів як, наприклад, мейоз або гіпермутація. У багатоклітинних організмах мутації можуть бути підрозділені на генеративні мутації, які можуть бути передані нащадкам, і соматичні мутації. Соматичні мутації не можуть передаватися до нащадків у тварин. Мутації розглядаються як рушійна сила еволюції,Нейтральні мутації визначаються як мутації, чиї ефекти не впливають на виживання видів або індивідуумів, які складають види. Вони також можуть накопичуватися. Мутації були відкриті де Фрізом. Зміни в ДНК, викликані мутацією, можуть викликати помилки в послідовності білка, створюючи частково або цілком нефункціональні білки. Мутагени — фізичні і хімічні чинники, що викликають стійкі спадкові зміни — мутації. Мутагенами можуть бути різні чинники, що викликають зміни в структурі генів, змінюють структуру і кількість хромосом.
Фізичні мутагени
Іонізуюче випромінювання;
Радіоактивний розпад;
Ультрафіолетове випромінювання;
Хімічні мутагени
Окисники та відновники (нітрати, нітрити, активні форми кисню);
Алкілуючі реагенти (наприклад, йодацетамід);
Пестициди (наприклад гербіциди, фунгіциди);
Біологічні мутагени
Специфічні послідовності ДНК — мігруючі генетичні елементи;Деякі віруси (вірус кору, краснухи, грипу);
33. Транскрипція, її механізм і значення. Посттранскрипційна модифікація первинного транс крипту
Транскрипція — процес синтезу РНК з використанням ДНК як матриці, що відбувається у всіх живих клітинах, іншими словами, це перенесення генетичної інформації з ДНК на РНК. Транскрипція каталізується ферментом ДНК-залежною РНК-полімеразою. Процес синтезу РНК протікає в напрямку від 5'- до 3'- кінця, тобто РНК-полімераза рухається матричним (також антизмістовним) ланцюжком ДНК у напрямку 3'→5'. Ділянка ДНК, на якій відбувається синтез РНК носить назву — транскриптон. Процес синтезу РНК можна розділити на чотири основні стадії: Зв'язування РНК-полімерази з промотором, Зв'язування РНК-полімерази з промотором включає принаймні два етапи. На першому РНК-полімераза утворює з промотором закритий комплекс. На другому закритий комплекс перетворюється у відкритий, в якому РНК-полімераза розплітає приблизно один виток подвійної спіралі ДНК в районі стартової точки-нуклеотиду, з якого починається комплементарне копіювання матриці. Початок синтезу ланцюга РНК (ініціація), При наявності субстратів РНК-полімераза у відкритому комплексі здійснює ініціацію. На стадії ініціації утворюється РНК, що пов'язана з матрицею і ферментом неміцно і може відокремитися від комплексу. В цьому випадку РНК-полімераза, не залишаючи промотора, знову ініціює РНК. Стадія ініціації завершується, коли ланцюг РНК досягає критичної довжини. Зростання ланцюга РНК (елонгація), Вважають, що в процесі елонгації приблизно 13 нуклеотидів РНК утворюють гібридну спіраль з матричної ниткою розплетеного ДНК. У міру руху РНК-полімерази по матриці попереду неї відбувається розплітання, а позаду відновлення подвійної спіралі ДНК. Ланцюг РНК зростає в напрямку 5 ': 3' у міру просування РНК-полімерази по ланцюгу ДНК в напрямку від 3'-кінця до 5'-кінця. На стадії елонгації до складу комплексу входить ряд додаткових білків, від яких залежить перебіг завершальної стадії транскрипції - термінаціі. Один з таких білків, займає в РНК-полімеразі місце s-субодиниці. Завершення синтезу ланцюга РНК (термінація). Термінація транскрипції, як правило, відбувається в суворо визначених ділянках матриці - термінаторах, в яких від матриці відокремлюються РНК і РНК-полімераза; остання, об'єднавшись з вільною s-субодиницею, може вступити в наступний цикл транскрипції. Постранскрипційна модифікація РНК У клітинах прокаріотів молекули мРНК синтезуються одразу у «зрілому» вигляді, тобто готовими до виконання своїх біохім функцій. На відміну від цього, в результаті процесів біосинтезу полірибонуклеотидів в еукаріотичних клітинах, утворюється первинний транскрипт (пре-мРНК), який здатний до перетворення у повноцінну молекулу в результаті реакцій посттранскрипційної модифікації – процесингу (дозрівання). Процесинг включає: приєднання до 5'-кінця так званого «кепу» приєднання до 3'-кінця «хвоста» - poly (A) вирізання неінформативних послідовностей (інтронів) нуклеотидів з молекули пре-мРНК та зшивання внутрішніх кінців молекул – сплайсинг
34. Поняття генетичного коду та його властивості
Генетичний код — набір правил розташування нуклеотидів в молекулах нуклеїнових кислот (ДНК і РНК), що надає всім живим організмам можливість кодування амінокислотної послідовності білків за допомогою послідовності нуклеотидів. У ДНК використовується чотири нуклеотиди — аденін (А), гуанін (G), цитозин (С) і тімін (T). У РНК використовуються ті ж нуклеотиди, за винятком тиміну, який замінений схожим нуклеотидом, — урацилом, який позначається буквою U. Для синтезу білків в природі використовуються 20 різних амінокислот. Експресія генів або реалізація генетичної інформації у живих клітинах здійснюється за допомогою двох основних матричних процесів: транскрипції (тобто синтезу мРНК на матриці ДНК) і трансляції генетичного коду в амінокислотну послідовність (синтез поліпептидного ланцюжка на матриці мРНК). Для кодування 20 амінокислот, а також стоп-сигналу, що означає кінець білкової послідовності, достатньо трьох послідовних нуклеотидів. Набір з трьох нуклеотидів називається кодоном. Властивості генетичного коду Триплетність — три послідовно розміщені нуклеотиди кодують одну з 20 амінокислот, які разом утворюють триплет, або кодон. Безперервність — кодони не розділяються між собою, тобто інформація зчитується безперервно. Кожний з кодонів не залежить один від одного і під час біосинтезу зчитується повністю. Дискретність — один і той же нуклеотид не може входити одночасно до складу двох або більш кодонів. Специфічність — кожний кодон може кодувати лише одну амінокислоту. Завдяки цьому генетичний код не перекривається. Виродженість — одна і та ж амінокислота може кодуватися декількома різними кодонами. Колінеарність — послідовність кодонів нуклеотидів точно відповідає послідовності амінокислотних залишків у поліпептиді Наявність термінальних кодонів — беззмістовних, або стоп-кодонів, які не здатні кодувати амінокислоти. Вони виконують функцію роздільника між двома ланцюгами кодонів та переривають синтез поліпептиду. Універсальність — єдиний генетичний код є, практично, однаковим в організмах різного рівня складності — від вірусів до людини
35. Трансляція: її механізми, послідовність стадій синтезу білків, біо значення
ТРАНСЛЯЦІЯ (від лат. Translatio-передача), програмований генами процес синтезу білку. За допомогою трансляції здійснюється реалізація генетичної інформації нуклеїнових кислот. Під час трансляції відбувається як би переклад з мови нуклеотидної послідовності гена на мову амінокислотної послідовності білку. Трансляція кожної молекули мРНК рибосомою розділяється на три чіткі послідовні стаді - ініціацію, елонгацію поліпептиду (власне трансляція) і термінацію. Ланцюг мРНК транслюється (зчитується) у напрямку від 5'-кінця до 3'-кінця. Поліпептид елонгується (зростає) від N-кінця до С-кінця. Ініціація синтезу білка. Для початку синтезу поліпептидного ланцюга необхідні: рибосома, мРНК, яка ініціює N-форміл-метіоніл-тРНК, білкові чинники ініціації та ГТФ. У всіх синтезованих білках першої амінокислотою є N-формілметіонін, який кодується кодоном мРНК АУГ, названим ініціюючим кодоном. В результаті узгодженої дії всіх учасників етапу ініціації відбувається збірка транслюючої рибосоми – комплексу, що складається з рибосоми, мРНК і N-формілметіоніл-тРНК. Збірка транслюючої рибосоми є енергозалежним процесом, енергію для якого поставляє гідроліз ГТФ. У транслюючої рибосоми виділяють два центри: пептидний (Р) і аміноацільний (А). На етапі ініціації N-формілметіоніл-тРНК приєднується до мРНК в пептидилому центрі, всі наступні аміноацил-тРНК приєднуються до мРНК в аміноацильному центрі. Елонгація поліпептидного ланцюга. На етапі елонгації відбувається поступове нарощування поліпептидного ланцюга. Для здійснення етапу елонгації необхідні: транслююча рибосома, аміноацил-тРНК, що відповідає певному кодону мРНК, вона наступає за кодоном АУГ, фермент пептидилтрансфераза, білкові чинники елонгації, дві молекули ГТФ на кожний знову утворюваний пептидний зв'язок Етап елонгації умовно можна розбити на три стадії. Перша стадія відповідає за правильне закріплення аміноацил-тРНК на відповідному кодоні мРНК в аміноацильному центрі рибосоми. Цьому сприяють білкові фактори елонгації. На другій стадії відбувається утворення пептидного зв'язку між двома амінокислотними залишками; каталізує цей процес пептидилтрансфераза. На третій стадії елонгації відбуваються три переміщення. Рибосома пересувається уздовж мРНК на відстань одного кодону. В результаті такого переміщення кодон АУГ і тРНКмет виявляються за межами рибосоми, в пептидильному центрі розташовується дипептидил-тРНК, а аміноацильний центр звільняється для нової аміноацил-тРНК. Третя стадія елонгації є прикладом спрямованого біологічного руху, який має назву транслокація. Після транслокації рибосома готова до нового етапу елонгації. Енергетичні потреби транс локації забезпечує гідроліз ГТФ до ГДФ. Елонгація повторюється стільки раз, скільки смислових кодонів містить мРНК. Термінація поліпептидного ланцюга. Етап термінації забезпечують білкові фактори термінації і фермент пептидилестераза, локалізований у великій субчастині рибосоми. Енергію для здійснення етапу термінації забезпечує гідроліз ГТФ. У структурі мРНК є кодони, які не несуть інформацію. Такими кодонами є УАА, УАГ, УГА. Ці кодони (або один з них) розташовані відразу за останнім смисловим кодоном мРНК. Їх упізнають білкові рилізинг-фактори термінації. Як тільки рибосома досягає одного з них, фактори термінації приєднуються і спричиняють гідроліз зв'язку між пептидом та молекулою тРНК. Завершальний фазою термінації, а отже, и всього процесу трансляції, є вивільнення пептиду, що синтезувався та дисоціація рибосоми на субодиниці.
36. Рибосомальна білоксинтезуюча система: компоненти та їх функції
Синтез білку здійснюється за допомогою складної білоксинтезуючої системи. До її складу входять такі компоненти: Рибосоми – рибонуклеопротеїдні субклітинні структури, які є місцем синтезу білків. Матрична РНК (мРНК) – матриця містить лінійну послідовність кодонів, що визначають первинну структуру білків. a-L-амінокислоти – субстрати для синтезу білків тРНК – тРНК виконують функцію адапторів. Вони акцепторним кінцем взаємодіють з амінокислотами, а антикодоном - з кодоном мРНК. аміноацил- тРНК-синтетаза – кожна аа-тРНК-синтетаза каталізує реакцію специфічного зв'язування однієї з 20 амінокислот з відповідною тРНК. Білкові фактори ініціації (eIF у еукаріотів), білкові фактори елонгації, (eEF у еукаріотів), білкові фактори термінації (eRF у еукаріотів) – Специфічні позарибосомні білки, необхідні для процесу трансляції (12 факторів ініціації: eIF; 2 фактора елонгації: eEFl, eEF2, і фактори термінації: eRF) ГТФ та АТФ – джерела енергії
37. Посттрансляційна модифікація поліпептидних ланцюгів
Після завершення трансляції велика частина білків піддається подальшим хімічним модифікаціям, які називаються посттрансляційні модифікації. Посттрансляційні модифікації можуть регулювати тривалість існування білків в клітині, їх ферментативну активність і взаємодії з іншими білками. У ряді випадків посттрансляційні модифікації є обов'язковим етапом дозрівання білка, в іншому випадку він виявляється функціонально неактивним. Наприклад, при дозріванні інсуліну і деяких інших гормонів необхідний обмежений протеоліз поліпептидного ланцюга. Один і той же білок може піддаватися численним модифікаціям. Посттрансляційні модифікації ділять на: модифікації головного ланцюга; відщеплення N-кінцевого залишку метіоніну; обмежений протеоліз - видалення фрагмента білка, яке може відбуватися з кінців (відщеплення сигнальних послідовностей) або, в окремих випадках, в середині молекули (дозрівання інсуліну); приєднання різних хімічних груп до вільних аміно- і карбоксильної груп (N-ацилювання і ін.); модифікації бічних ланцюгів амінокислот; приєднання або відщеплення невеликих хімічних груп (глікозилювання, фосфорилювання і ін.); приєднання ліпідів і вуглеводнів; зміна стандартних амінокислотних залишків на нестандартні (утворення цитруліну); утворення дисульфідних містків між залишками цистеїну; приєднання невеликих білків
38. Фарм препарати – регулятори синтезу нуклеїнових кислот та білків
Антибіотики:
-Інгібітори ініціації: стрептоміцин
-Інгібітори елонгації: хорамфенікол, еритроміцин, циклогексимід, пуроміцин, тетрациклін
-Інгібітори термінації: анізоміцин, хорамфенікол, еритроміцин, лінкоміцин, стрептоміцин
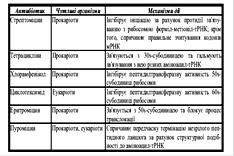
Інтерферони – впливають на процес ініціації, фосфорилюючи клітинні фактори ініціації eIF-2, гальмують біосинтез білків як вірусних та і всіх білків клітини, в яку вірус потрапив.
39. Клініко-діагностичне значення дослідження вмісту сечової кислоти у плазмі крові та сечі
Сечова кислота - показник обміну пуринів, необхідна для діагностики і контролю лікування подагри і інших захворювань. Сечова кислота - це кінцевий продукт метаболізму пуринів, далі пурини не розпадаються. Пурини необхідні організму для синтезу нуклеїнових кислот - ДНК і РНК, енергетичних молекул АТФ і коферментів.
Джерела сечової кислоти:
з пуринів їжі
з клітин організму, що розпалися - в результаті природної старості або захворювання
сечову кислоту можуть синтезувати практично всі клітини людського тіла
Сечова кислота в крові - урикемія, а в сечі - урикозурія. Підвищення сечової кислоти в крові - гіперурикемія, зниження - гіпоурикемія. Дослідження рівня сечової кислоти в крові та сечі проводиться з метою оцінки обміну пуринів в організмі - обсягів надходження, трансформації і виведення нирками, що дає цінну інформацію про роботу печінки, нирок, м'язів і кровотворення.
40. Гормони та гормоноподібні речовини. Класифікація гормонів
Гормони (від грец. Гормао - збуджую, спонукаю до руху) в широкому сенсі - це сигнальні речовини різноманітної хімічної природи, які виробляються клітинами організму і діють на інші клітини цього ж організму. Такі неспецифічні гормони ще називають гормоноїдами (від гормон і грец. Еідос - вид), або «гормоноподібними речовинами». Вони утворюються в усіх багатоклітинних організмів. Гормони (у вузькому сенсі) – це біологічно активні речовини регуляторної природи, які мають вузько направлений дію, вони виробляються специфічними клітинами або залозами. Гормони є високо - специфічними, оскільки клітини, на які спрямована їх дія на своїй поверхні мають спеціальні ділянки - рецептори, які взаємодіють з молекулами певних гормонів. Саме тому гормони здатні діяти по надзвичайно низькій концентрації.
Класифікація гормонів і БАР за хімічною структурою:
Похідні амінокислот:
похідні тирозину: тироксин, трийодтиронін, дофамін, адреналін, норадреналін;
похідні триптофану: мелатонін, серотонін;
похідні гистидина: гістамін.
Білково-пептидні гормони:
поліпептиди: глюкагон, вазопресин, окситоцин, пептидні гормони шлунка і кишечника;
прості білки (протеїни): інсулін, соматотропін, пролактин, паратгормон, кальцитонін;
складні білки (глікопротеїди): тиреотропин, фоллітропін, лютропін.
Стероїдні гормони: кортикостероїди (альдостерон, кортизол, кортикостерон) та статеві гормони: андрогени (тестостерон), естрогени і прогестерон.
Похідні жирних кислот: арахідонової кислоти та її похідні: простагландини, простацикліни, тромбоксани, лейкотрієни.
Функціональна класифікація гормонів:
Ефекторні гормони - гормони, які впливають безпосередньо на орган-мішень.
Тропні гормони - гормони, основною функцією яких є регуляція синтезу і виділення ефекторних гормонів. Виділяються аденогіпофізом.
Рилізинг-гормони - гормони, що регулюють синтез і виділення гормонів аденогіпофіза, переважно тропів. Виділяються нервовими клітинами гіпоталамуса
41. Загальній властивості гормонів. Органи-мішені та клітинні рецептори
Властивості:
1) утворюються спеціалізованими клітинами ендокринних залоз
2) секретуються безпосередньо в кров
3) характеризуються специфічністю впливу, який пов'язаний із існуванням клітин-мішеней
4) мають високу біологічну активність, проявляють дію у низьких концентраціях
5) володіють дистантною дією, бо впливають на клітини, що розташовані на великій відстані від місця утворення гормонів.
Мішені (клітини, тканини, органи) або гормонокомпетентні структури - чутливі до гормону біоструктури, які вибірково відповідають на взаємодію з гормоном специфічною фізіологічною або біохімічною реакцією. Здатність клітин-мішеней специфічним чином реагувати на певний гормон визначається наявністю рецепторних молекул, що сполучаються з гормонами або хімічно близькими до нього сполуками






