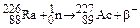Содержание цинка в земной коре (см. табл.3.3.) составляет приблизительно 0,01 %. Цинк и его аналоги входят в состав полиметаллических руд.
Кадмий довольно редкий элемент (»10-5%), собственных руд не образует. Чаще сопутствует цинку.
В самородном состоянии иногда встречается ртуть (в виде вкраплений в горные породы). В Италии встречались колодцы на дне которых находилась Hg (до 4,5 т).
Важнейшие минералы: ZnS-цинковая обманка (сфалерит); ZnCO3 - галмей; CdS- гринокит; HgS- киноварь.
Все металлы получают пирометаллургическим способом:
- окислительный обжиг сопровождается переводом сульфидов в оксиды, с последующим их восстановлением углем: ZnO+ C = Zn + CO.
Кроме того, цинк получают электролитическим способом. Для этого цинковую руду обрабатывают серной кислотой и полученный раствор сульфата цинка подвергают электролизу.
Кадмий чаще всего входит в состав цинковых руд. Из отходов цинкового производства, обработанных серной кислотой, металлический кадмий выделяют цинком:
CdSO4 + Zn = Cd + ZnSO4
Получение металлической ртути из HgS протекает в одну стадию, так как HgO при высоких температурах неустойчив:
HgS + O2 = Hg + SO2
Ртуть выделяется в виде паров, которые конденсируются в охлажденном приемнике.
Физические свойства
При обычных условиях все металлы подгруппы цинка имеют серебристо-белый цвет, диамагнитны, относительно низкие температуры кипения и плавления (см.табл.3.3.).
Таблица 3.3.
Некоторые свойства элементов подгруппы цинка
| Металл | R ат., нм | Плотность, г/см3 | J ион., эВ | Стандартный электродный потенциал процесса: Э2++2е- = Э,В | T пл.., 0C | Tкип.,0C | Содержание в земной коре, % | Относительная электроотрицательность по Полингу |
| Zn | 0,107 | 7,13 | 9,38 | -0,76 | 419,5 | 1,5×10-3 | 1,6 | |
| Cd | 0,118 | 8,65 | 8,99 | - 0,40 | 8×10-5 | 1,7 | ||
| Hg | 0,113 | 13,55 | 10,43 | 0,85 | -39 | 6×10-7 | 1,9 |
Hg- жидкость, Cd-ковкий, тягучий металл, Zn- хрупок, при 100-150 0С становится ковким. При 200 0С – снова хрупким. Все металлы легкоплавки и летучи.
Из табл.3.3. видно происходит увеличение радиуса атома от цинка к кадмию, а при переходе к ртути радиус атома уменьшается. Энергия ионизации при переходе от Zn к Cd увеличивается и резко возрастает Hg. Это обьясняется как “ лантаноидным сжатием”, так и экранированием 6S2-электронов 5d10 и 4f14 -электронами.
Химические свойства
По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. табл.3.3.).
Если цинк, кадмий в некоторых отношениях похожи на s-элементы, то ртуть ближе к серебру или меди.
В воде эти металлы не растворимы, так как их поверхность покрыта слоем труднорастворимого гидроксида.
Отношение к неметаллам. Zn и Cd окисляются кислородом уже при комнатной температуре, образуя прочную оксидную пленку, Hg - только при нагревании, с образованием HgO.
При нагревании все металлы взаимодействуют с галогенами, серой и фосфором, что можно представить в виде схемы:

Ртуть с галогенами и S реагирует уже при обычной температуре, с образованием HgCI2 и HgS. Эту реакцию используют для связывания разливной ртути, посыпают порошком серы. Она способна растворять многие металлы, образуя с ними частью жидкие, частью твердые растворы (амальгамы), на чем основано разделение золота от неметаллических примесей.
Отношение к кислотам. В электрохимическом ряду напряжений Zn, Cd, стоят до Н, а Hg-после водорода (табл.ПРИЛОЖ.1).
Так, Zn активно взаимодействует как с разбавленными, так и с концентрированными кислотами, например:
Zn + 2 НС1 = ZnС12 + Н2
4Zn + 10 HNO3(разб) = NH4NO3 + 4 Zn(NO3)2 + 3 H2O
Кадмий взаимодействует менее энергично:
3Cd + 8HNO3(разб)  3 Cd(NO3)2 + 2NO + 4 H2O
3 Cd(NO3)2 + 2NO + 4 H2O
Ртуть взаимодействует только с кислотами-окислителями, образуя производные как Hg (+1), так и Hg(+2):
Hg + 4 HNO3 (конц) = Hg(NO3)2 + 2NO2 + 2 H2O
6Hg + 8HNO3(Разб) = 3Hg2(NO3)2 + 2NO + 2 H2O
Отношение металлов подгруппы цинка к кислотам можно представить схемой:

Отношение к щелочам. В отличие от кадмия и ртути Zn при нагревании взаимодействует с растворами щелочей, с выделением водорода:
Zn + 2 NaOH +2 H2O  Na2[Zn(OH)4] + H2
Na2[Zn(OH)4] + H2
Благодаря высокой восстановительной способности цинк может восстанавливать нитраты до аммиака:
4 Zn + NaNO3 +7NaOH + 7H2O = 4 Na2[Zn(OH)4] + NH4OH
Из водных растворов цинкат натрия выпадает в виде кристаллогидрата Na2ZnO2×4H2O.
Соединения металлов
В связи с устойчивостью конфигурации 6S2 Hg обладает отличительными свойствами от свойств Zn и Cd. В частности, соединения ртути +2 малоустойчивы. Устойчивость соединений от Zn к Hg падает.
В отличие от цинка и кадмия ртуть способна образовывать соединения кластерного радикала Hg2+2. Атомы связаны ковалентной связью -Hg-Hg-, т.е. снова возникает конфигурация 6S2. Степень окисления ртути в этих соединениях принимается равно +1. Для ртути (I) известен оксид, галогениды, некоторые соли.
Оксиды. Все эти элементы образуют с кислородом оксиды:
ZnO CdO HgO Hg2O
бел. корич. красн. или черн.
оранж.
Тпл, 0С 1975 возгоняется разлагается разлагается
при 7000С при >4000С при >1000С
Все оксиды – кристаллические вещества, нерастворимые в воде. ZnO, CdO - амфотерны, а HgO обладает основными свойствами. Со щелочами ZnO и CdO образуют анионные комплексы типа: K2[Zn(OH)4], K4[Cd (OH)6]. Хорошо растворяются в кислотах, образуя аквакомплексы:
ZnO + 2 HCI + 5H2O = [Zn(H2O)6]CI2
Поэтому для этих элементов характерны кристаллогидраты, например: Zn(NO3)2×2H2O; ZnSO4×7H2O; Cd(NO3)2×4H2O; Hg(NO3)2×2H2O.
Существующий субоксид ртути (I) Hg2О имеет строение:

проявляет окислительно-восстановительные свойства в зависимости от условий. Для его характерны реакции диспропорционирования:
Hg2О  HgО + Hg,
HgО + Hg,
поэтому не всегда удается получить этот ион.
Гидроксиды. Обменной реакцией взаимодействия солей со щелочами могут быть получены гидроксиды Zn(OH)2, Cd(OH)2, например:
Zn(NO3)2 + 2 NaOH = Zn(OH)2¯ + 2 NaNO3
Это белые кристаллические вещества; термически нестойки, при нагревании (>125-1300С) переходят в соответствующие оксиды.
Гидроксид ртути Hg(OH)2-неизвестен, так как разлагается уже в момент образования:
 HgCI2 + Ba(OH)2 = Hg(OH)2 + BaCI2
HgCI2 + Ba(OH)2 = Hg(OH)2 + BaCI2
HgO H2O
В ряду: Zn(OH)2 -Cd(OH)2-Hg(OH)2 происходит

Так, Zn(OH)2- типичное амфотерное соединение:
Zn(OH)2 + H2SO4 = ZnSO4 + 2 H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Zn(OH)2 + 2 NaOH  Na2ZnO2 + 2 H2O
Na2ZnO2 + 2 H2O
Cd(OH)2 проявляет кислотные свойства в меньшей степени, но при длительном нагреве в концентрированном растворе щелочи образует гидроксокомплекс: K4[Cd(OH)6], который легко разлагается водой. Гидроксогидраргираты- не выделены.
Все гидроксиды хорошо растворимы в избытке аммиака, с образованием аммиакатов: [Zn(NH3)4](ОН)2; [Cd(NH3)4](NO3)2. Однако комплексный ион цинка более устойчив: Кн[Zn(NH3)4]2+ = 4×10-10, Кн[Сd(NH3)4]2+ = 8×10-8.
Соли. Известны галогениды, общей формулой ЭHaI2. Все они кроме ZnF2, HgBr2, HgJ2 растворимы в воде, в избытке аммиака и в растворах щелочей, например:
CdCI2 + 2 NaCI = Na2[CdCI4]
HgCI2 + 2 NH3  [Hg(NH3)2CI2]
[Hg(NH3)2CI2]
CdCI2 + 4 NaОН = Na2[Cd(ОН)4] + 2 NaС1
В разбавленных растворах аммиака сулема HgCI2 образуется нерастворимое амидное соединение HgNH2CI /2/:
HgCI2 + NH3 = HgNH2CI ¯ + NH4CI
Некоторые соли ртути: Hg(СN)2, HgСI2(сулема) - довольно хорошо растворяются в воде, но при этом не диссоциируют (их растворы не проводят электрический ток).
Сульфиды получают действием сульфида аммония на сульфатные растворы цинка или кадмия, а также действием H2S (CdS, HgS). Образовавшиеся: ZnS— CdS— HgS белого, желтого и черного цветов, соответственно.
В избытке сульфидов щелочных металлов HgS растворяется с образованием комплексных солей типа: Na2[HgS4], а также в “ царской водке”:
HgS + 2HNO3 + 4HCI =H2[HgCI4] +2NO +SO2 + 2H2O
Сульфид цинка не растворяется в растворах слабых кислот (СН3СООН), но растворяется в растворах сильных кислот (НС1разб). Сульфид кадмия вообще не растворим в кислотах.
Катионы подгруппы цинка подвержены гидролизу как катионы слабых оснований, например:
Zn(NO3)2 + H2O= ZnOHNO3 +HNO3
Соли ртути (I) неустойчивы. Исходным веществом для получения других соединений Hg+1 служит Hg2(NО3)2. Нерастворимая соль Hg2СI2 (каломель), белый порошок. Сульфид Hg2S, цианид ртути(I) Hg2(CN)2 – не получены, так в момент получения они диспропорционируют: Hg2(CN)2= Hg + Hg(CN)2.
Комплексные соединения. Катионы подгруппы цинка образуют многочисленные производные анионных комплексов типа М2[Э(SCN)4], М2[Э(SO4)2], М2[Э(NO3)4], по устойчивости относящиеся к двойным солям, а также кристаллогидраты, например М2[ Э(SO4)2] ×6Н2О/2/.
Устойчивость галогенидных комплексов в ряду: Zn+2 -Cd+2 - Hg+2 увеличивается, так как в ряду Zn+2—Cd+2—Hg+2 электронно-донорная способность возрастает, вследствие увеличения размеров (n-1)d. Для Zn и Cd характерны к.ч. 4 и 6, для Hg- 2,4,6.
Комплексные галиды цинка малоустойчивы, их можно отнести к двойным солям, а комплексные галиды ртути (+2) – очень устойчивы и легко образуются в избытке KJ:
HgJ2 + 2 KJ = K2[HgJ4]
красный
Тетраиодомеркурат (II) калия является важным аналитическим реактивом:
2 K2[HgJ4] + NH3 + 3KOH ® HO-Hg-NH-HgJ +7KJ + 2 H2O
называемый реактив Несслера.
Окислительные свойства соединений. Соединения Zn+2 -- Cd+2-- Hg+2 проявляют окислительные свойства, причем окислительная активность в ряду от цинка к ртути возрастает, например:
HgCI2 + 2Н2О + SO2 = Hg + H2SO4 +2HCI
Так, если просуммировать реакции:
2Hg2+ + 2e-= Hg22+, E0298 = 0,92В
Hg2+ + 2e-= Hg0, E0298 = 0,854В
получим: Hg + Hg2+ = Hg22+, ЭДС которой равен 0,92-0,854=0,067 В. Следовательно, ионы Hg2+ в присутствии Hg способны превращаться в Hg22+ по реакции: Hg(NО3)2 + Hg = Hg2(NО3)2.
В зависимости от условий соединения ртути (I) могут проявлять восстановительные например:
Hg2CI2 +СI2 = 2 HgCI2
или окислительные свойства
Hg2CI2 +SnС12 = 2 Hg + SnCI4
Применение
Цинк применяется для нанесения покрытий на железные и стальные изделия с целью защиты их от коррозии; для изготовления сплавов с алюминием, медью и магнием; для изготовления гальванических элементов.
Кадмий широко поглощает медленные нейтроны, поэтому кадмиевые стержни применяют в ядерных реакторах для регулирования скорости цепной реакции. Используется кадмий в щелочных аккумуляторах и для получения легкоплавких сплавов. Сплавы кадмия с медью (кадмиевая бронза) служат для изготовления телеграфных, телефонных и троллейбусных проводов, так как они обладают повышенной прочностью и износостойкостью, чем медь. Подобно цинку кадмий используется для покрытий стальных изделий (в морской воде).
Металлическая ртуть применяется в различных приборах: термометры, кварцевые лампы, диффузионные вакуумные насосы и др. Ртуть используют в качестве катода (-) при электролизе раствора NaCI, а также в качестве катализатора при получении ряда органических веществ.
Пары ртути и все её соединения ядовиты.
Применение соединений цинка и его аналогов весьма разнообразно. Так, сульфиды этих металлов применяют в производстве красок. HgC12 –сулема используют в медицине как сильнодействующее дезинфицирующее средство; Hg2C12 –каломель и другие препараты ртути, а также цинка применяют в медицине. Сульфид цинка ZnS способен люминесцировать - светиться в темноте после предварительного освещения. На этом основано его применение при работе с радиоактивными препаратами и в рентгенотехнике. Сульфид кадмия CdS применяется в качестве фотосопротивления, т.е. вещества электросопротивление которого зависит от интенсивности падающего на него света.
Вопросы и упражнения
1. Напишите электронные формулы атомов элементов подгруппы IIB. Определите их степени окисления.
2. Приведите основные минералы металлов.
3. Сущность пирометаллургического способа извлечения цинка и кадмия из сульфидных руд?
4. Какие процессы протекают при переходе: ZnS® ZnO® ZnSO4® Zn(OH)2?
5. Чем объясняется устойчивость цинка и кадмия на воздухе?
6. Почему ртуть не вытесняет водород из кислот?
7. Охарактеризуйте поведение цинка и кадмия в растворах щелочей.
8. Закончите уравнения реакций взаимодействия и подберите коэффициенты в уравнениях: Zn + H2SO4(k)®….. Cd + H2SO4 (p)®…., Hg + HNO3(k)®…., Cd + HCI ®…, Cd + NaOH®….
9. Чем можно объяснить то, что цинк реагирует с серой при нагревании, а ртуть – при обычных условиях, хотя цинк является более активным металлом?
10. При термическом разложении 17 г нитрата серебра с образованием серебра, оксида азота(IV) и кислорода поглотилось 15,5 кДж теплоты. Определите энтальпию образования нитрата серебра, если энтальпия образования оксида азота (IV) равна 33,5 кДж/моль. (Ответ: 121 кДж/моль).
Элементы подгруппы IIIA
Подгруппа скандия
Скандий Sc, иттрий Y, лантан La и актиний Ac составляют подгруппу скандия, элементы подгруппы ШВ. Внешний валентный слой их отвечает формуле(n-1)d1ns2. Наличие одного электрона на d- подуровне обусловливает малую устойчивость данной конфигурации. Поэтому все элементы подгруппы скандия имеют постоянную степень окисления +3.
Способы получения
В земной коре элементы подгруппы скандия очень распылены и отдельных минералов не образуют. Получают их обычно электролизом расплавов хлоридов или чаще металлотермической обработкой хлоридов и оксидов:
Э2О3 + 3Mg  2Э +3MgO
2Э +3MgO
2ЭГ3+ЗСа  2Э + ЗСаF2
2Э + ЗСаF2
AcF3+3Li  Ac + 3LiF
Ac + 3LiF
Ас -также искусственным путем в ядерных реакторах: