Для металлов характерны три типа кристаллических решёток:
а) центрированный куб (ОЦК) (Fe, Cr, W, Ca, Na);
б) гранецентрированный куб (ГЦК) (Cu, Al, Ni, Pb, Ag);
в) гексагональная (шестигранная) призма (Zn, Mg, Co, Ti).
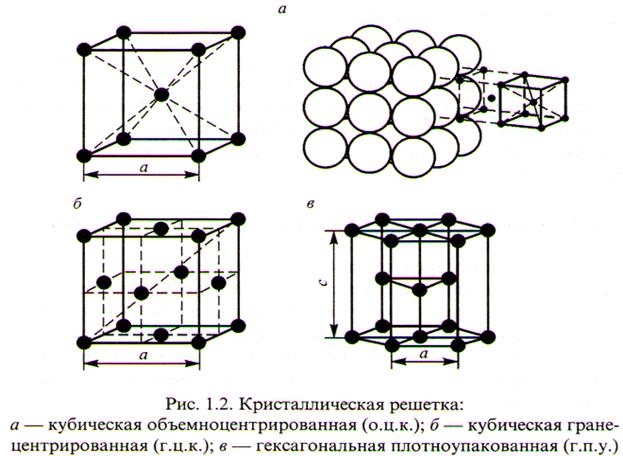 Решетки характеризуются величиной периодом, т.е. расстояния между соседними атомами (0,1-0,7нм).
Решетки характеризуются величиной периодом, т.е. расстояния между соседними атомами (0,1-0,7нм).
Кристаллические решётки реальных металлов имеют дефекты:
· вакансии - незаполненные узлы кристаллической решётки;
· внедрённые (лишние) атомы;
· 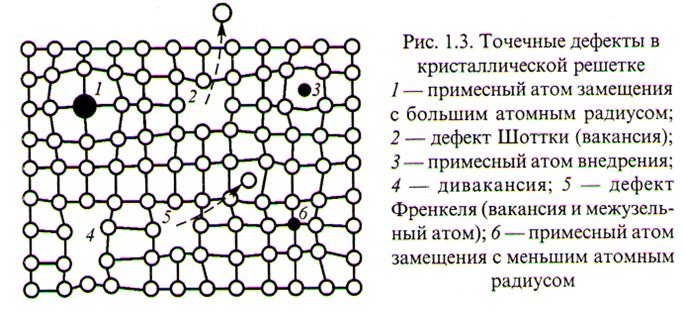 линейные несовершенства кристаллической решётки.
линейные несовершенства кристаллической решётки.
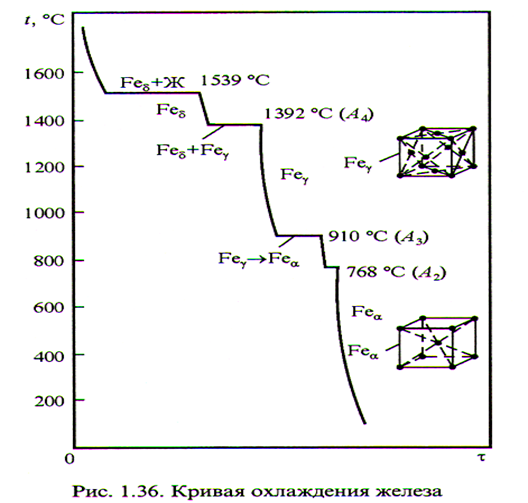
Металлы обладают способностью перестраивать кристаллическую решётку при определённых (критических) температурах в процессе нагрева или охлаждения, образуя модификации α, β, γ, δ. Это свойство металлов называют аллотропией.
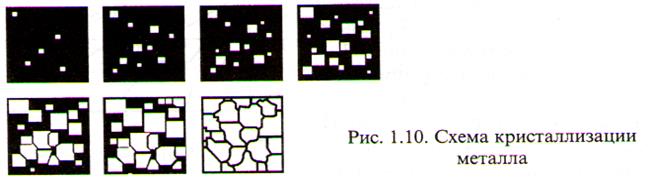
Первичной кристаллизацией называют процесс перехода из жидкого состояния в твёрдое. Процесс первичной кристаллизации происходит в два этапа:
1) Образование центров кристаллизации.
2) Рост кристаллов, вызывающий рост зёрен металла до их соприкосновения и образования плоскостей спайности.
Вторичной кристаллизацией называют называют процесс изменения кристаллической решетки в металле при его охлаждении (нагреве).
Процессы происходящие в металлах при нагреве и охлаждении исследуют во время термического анализа и фиксируются кривыми в координатах «время» - «температура».
Основы теории сплавов
В практике применение чистых металлов ограничено из-за сравнительно низких механических параметров. Для конструкционных изделий в основном применяют сплавы, состоящие из двух или нескольких металлов или металлов и неметаллов, при сохранении металлических свойств.
Получают сплавы обычно сплавлением компонентов, реже методом металлокерамики (т.е. спеканием порошков входящих в сплав компонентов).
Различают три вида сплавов:
1) Механическая смесь – представляет собой смесь кристаллов входящих в сплав компонентов, причём возможно любое их процентное соотношение.
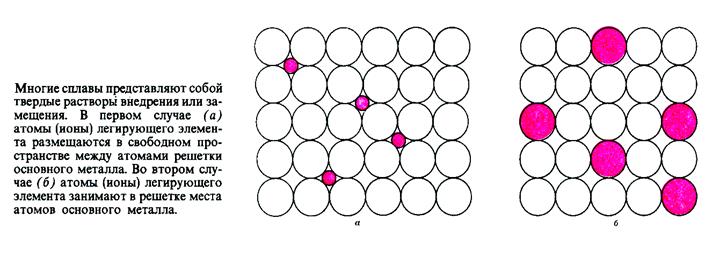
2) Твёрдый раствор – один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого компонента располагаются в решетке первого компонента.
Различают твёрдый раствор:
a) замещения – обычно это сплавы металлов с близкими размерами атомов;
б ) внедрения – обычно это сплавы металлов с неметаллами (например сплавы Fe-C).
3) Химические соединения – возможны при определённом соотношении компонентов. возможны при определённом соотношении компонентов. В результате химической реакции образуется сплав новой структуры с новыми свойствами (например цементит Fe3С при 6,67 % углерода)
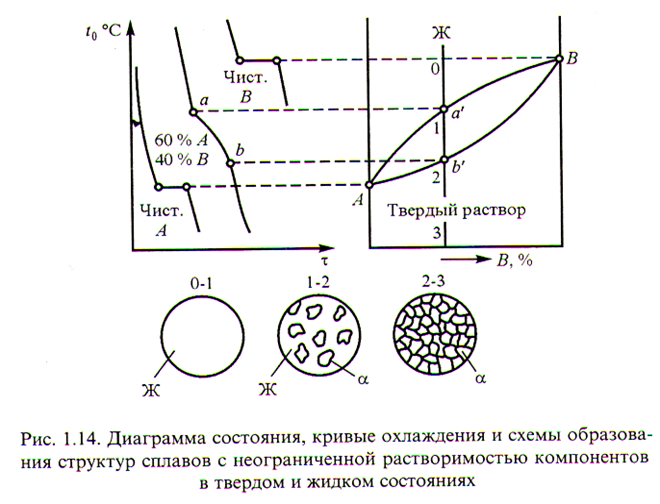
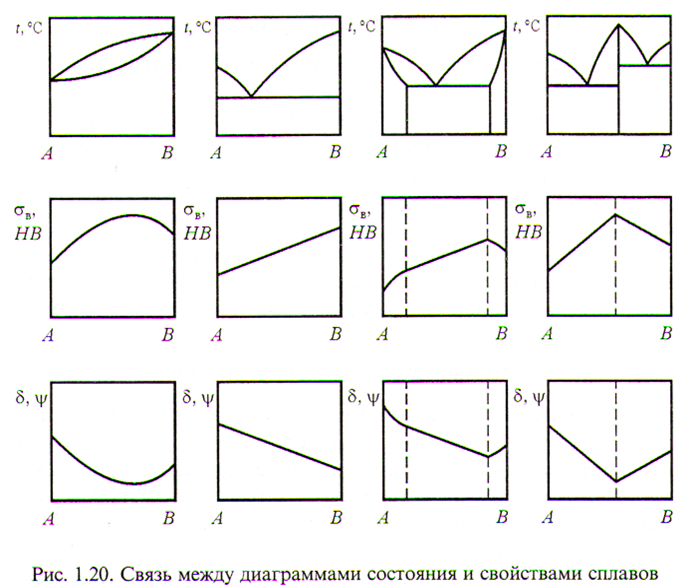
Сплавы кристаллизуются в определённом интервале температур, зависящем от концентрации компонентов, поэтому кривые охлаждения сплавов разной концентрации имеют разный вид.
Д иаграммы состояния сплавов дают наглядное представление о протекающих в сплавах превращениях в зависимости от их химического состава и температуры.
Для построения диаграммы состояния сплавов совмещают кривые охлаждения, построенные с определённым интервалом концентрации, на общем графике и соединяют плавными кривыми аналогичные критические точки.
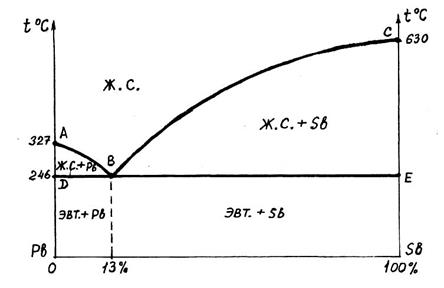
Диаграмма I типа (механическая смесь) на примере Свинец – Сурьма (Pb-Sb)
|
ABC – линия ликвидуса (жидкий) – выше температур этой линии все сплавы - в жидком состоянии.
DBE – линия солидуса (твёрдый) - ниже температур этой линии все сплавы- в твёрдом состоянии.
Между этими линиями происходит процесс первичной кристаллизации. В точке B, при строго определённой концентрации и самой низкой температуре, компоненты кристаллизуются одновременно образуя мелкую равномерную смесь зёрен входящих компонентов – эвтектику (хорошо построенный сплав).
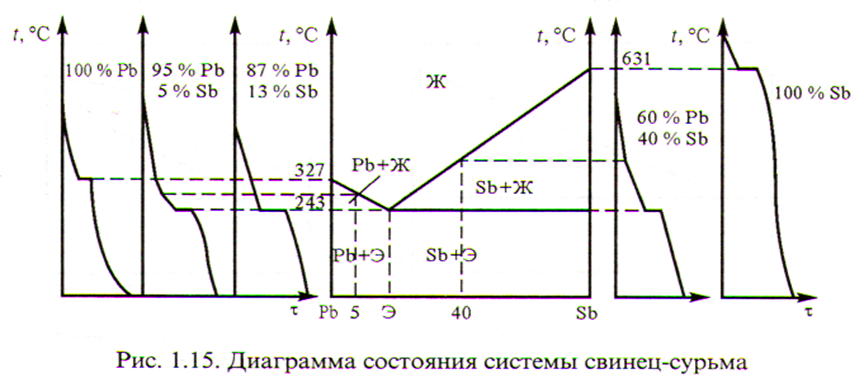
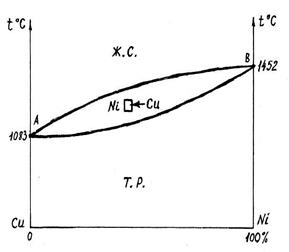
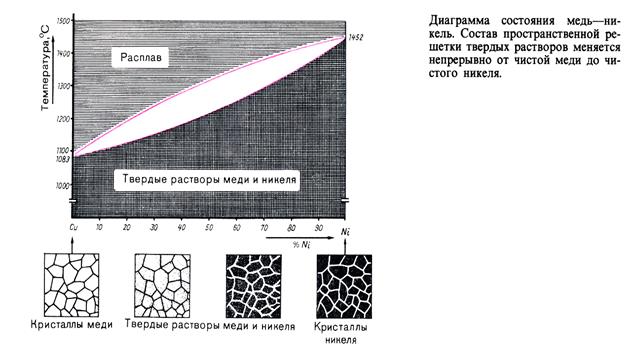
Диаграмма II типа (твёрдый раствор).
Медь – Никель (Cu-Ni)
| 
|
Сплавы кристаллизуются между линиями ликвидуса и солидуса. При охлаждении, в кристаллы более тугоплавкого никеля проникает медь, образуя твёрдый раствор меди в никеле.