К физико-химическим свойствам относятся высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкая осмотическая активность и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм.
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и COОH-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых (аспарагиновая, глутаминовая) и основных аминокислот (аргинин, лизин, гистидин) белки в растворе несут или отрицательный или положительный заряд, перемещаясь к аноду или катоду.
Значения рН, при котором как аминная, так и карбоксильная группы заряжены и эти заряды скомпенсированы, называют изоэлектрической точкой (ИЭТ, pI). ИЭТ каждого белка определяется соотношением кислых и основных групп. Если же аминокислота содержит дополнительные ионогенные группировки, то при расчете pI следует учитывать их вклад.
Изоэлектрическая точка большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что свидетельствует о частичном преобладании кислых аминокислот. В природе существуют белки, у которых значения изоэлектрических точек лежат в крайних значениях рН среды. Например, величина pI пепсина равна 1, а сальмина почти 12.
В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. pL белка в сильной степени зависит от присутствия в растворе ионов солей; в то же время на ее величину не влияет концентрация белка.
Белки обладают ярко выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. Молекулы белков не способны проникать через полупроницаемые мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей.
 Для выполнения функции белок должен иметь определенную конформацию – нативную структуру. Нативная конформация белка является лабильной и подвержена изменениям под влиянием химических агентов или энергетических и механических нагрузок. Под влиянием внешних факторов может произойти разрыв большого числа связей, стабилизирующих пространственную структуру белковой молекулы. Уникальная для каждого белка конформация пептидной цепи нарушается, и белковая молекула целиком или большая ее часть принимает форму беспорядочного клубка – происходит денатурация (рис. 7).
Для выполнения функции белок должен иметь определенную конформацию – нативную структуру. Нативная конформация белка является лабильной и подвержена изменениям под влиянием химических агентов или энергетических и механических нагрузок. Под влиянием внешних факторов может произойти разрыв большого числа связей, стабилизирующих пространственную структуру белковой молекулы. Уникальная для каждого белка конформация пептидной цепи нарушается, и белковая молекула целиком или большая ее часть принимает форму беспорядочного клубка – происходит денатурация (рис. 7).
При денатурации происходит потеря характерных для белка свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекул.
Классификация белков
В зависимости от химического состава белки делятся на простые и сложные.
Простые белки или протеины (франц. рroteine, греч. protos - первый) состоят только из остатков аминокислот. Среди них выделяют несколько групп, которые характеризуются определенными свойствами и функциями. Некоторые из них приведены в таблице 2.
Таблица 2
Группы простых белков
| Белки | Свойства | Примеры |
| Прота- мины | Обладают выраженными основными свойствами, хорошо растворимы в воде. Изоэлектрическая точка находится в щелочной среде (рН 10 -13) | Сальмин, клупеин (выделены из молок семги). Протамины составляют белковый компонент в структуре ряда сложных белков |
| Гистоны | Белки основного характера. Изоэлектрическая точка находится в щелочной среде (рН 8 - 11) | Сосредоточены в ядрах клетки, играют важную роль в упаковке ДНК и регуляции экспрессии генов |
| Прола- мины и глютелины | Белки растительного происхождения; растворимы в 60-80%-ном водном растворе этанола, в то время как другие белки выпадают в осадок | Содержатся в семенах злаков, составляют основную массу клейковины. Оризенин (из риса), глютенин, глиадин (из пшеницы), зеин (из кукурузы), гордеин (из ячменя) |
| Альбу- мины | Простые глобулярные белки, хорошо растворимы в воде, солевых растворах, разбавленных кислотах и щелочей; выпадают в осадок при насыщении раствора сульфатом аммония выше 50% | Лактальбумин (молоко), овальбумин (яичный белок), сывороточный альбумин (сыворотка крови), основные резервные белки организма |
| Глобу- лины | Глобулярные белки, растворимы в разбавленных растворах солей, кислот и щелочей; слаборастворимы в воде. Выпадают в осадок при насыщении раствора сульфатом аммония выше 50% | Входят в состав растительных и животных тканей. Составляют почти половину белков сыворотки крови. Некоторые глобулины связаны с углеводами, липидами, НК и определяют иммунные свойства организма (антитела, свертываемость крови и т.д.) |
Сложные белки или протеиды (франц. protos - первый, важнейший, греч. eidos - вид) – сложные белки, содержащие небелковый компонент – простетическую группу (греч. prostheto - присоединяю).
В зависимости от химической природы простетической группы сложные белки подразделяют на следующие классы: хромопротеиды (в состав входят пигменты); нуклеопротеиды (содержат нуклеиновые кислоты); липопротеиды (содержат липиды); фосфопротеиды (содержат фосфорную кислоту); гликопротеды (содержат углеводы); металлопротеиды (содержат металлы).
Хромопротеиды (от chroma - цвет, краска) – сложные окрашенные белки, содержащие в своем составе простетическую группу, определяющую спектр поглощения белка и его цвет. Хромопротеиды играют исключительно важную роль в процессах жизнедеятельности. В зависимости от структуры простетической группы хромопротеиды разделяют на гемопротеиды, флавопротеиды, фикобилины, ретинилиденпротеиды и др.
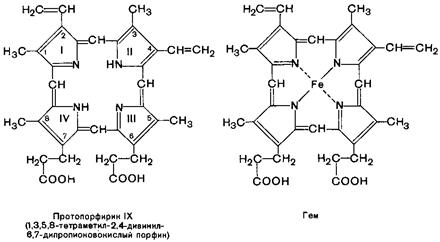
К группе гемопротеидов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки, ферменты (цитохрооксидазная система, каталаза, пероксидаза). В этих соединениях в качестве небелкового компонента выступает железо (магний) порфирин, а в качестве белкового компонента – разные по структуре и функциям белки. Гемоглобин, например, содержит белок глобин, а небелковый компонент – гем. Гем является простетической группой и у миоглобина, каталазы, пероксидазы, цитохромов. Гемоглобины участвуют в транспорте кислорода от легких к тканям; легко соединясь с другими газами, гемоглобин теряет способность связываться с кислородом.
Гемопротеиды принимают участие в таких процессах как дыхание, фотосинтез, транспорт кислорода, углекислого газа, окислительно-восстановительных реакциях, свето- и цветовосприятии и т.д.
Хлорофиллы содержат магнийпорфирины и обеспечивают фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород.
Миоглобин (белок мышц) связывает переносимый гемоглобином кислород и передает его окислительным системам клеток.
Цитохромы являются переносчиками электронов и содержатся во всех клетках организмов; локализованы в мембранах митохондрий, хлоропластов, хроматофоров и других мембранных структурах. Они принимают участие во всех основных группах окислительно-восстановительных процессов, протекающих в живых организмах – дыхании, фотосинтезе, микросомальном окислении.
К хромопротеинам относятся и флавопротеиды, простетическими группами у которых являются изоаллоксазиновые производные – ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид) (см. раздел «Ферменты»). Флавопротеиды входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке.
Фикобилины (пигменты красных водорослей и цианобактерии) содержат в составе небелковой части хромофорную группу, являющуюся аналогом желчных кислот. Пигменты участвуют в процессе фотосинтеза.
Нуклеопротеиды представляют собой сложные комплексы нуклеиновых кислот с белками. По характеру НК, входящей в состав нуклеопротеидов, различают дезоксинуклеопротеид (ДНП) и рибонуклеопротеид (РНК). ДПН содержатся в ядрах клеток, митохондриях. Белки в ДНП представлены гистонами и протаминами, расположенными в желобах двойной спирали ДНК. Белки стабилизируют структуру ДНП и регулируют ее матричную активность. Из РНП состоят рибосомы, вирусные частицы; РНП обнаружены также в ядре, ядрышках.
Липопротеиды – комплекс белков и липидов. Липопротеиды широко распространены в живых организмах и выполняют разнообразные функции. Они составляют структурную основу всех биологических мембран, в свободном состоянии присутствуют в основном в плазме крови и лимфе. Занимают ключевое положение в транспорте и метаболизме липидов. Липопротеиды (ЛП) плазмы крови классифицируются в зависимости от электрофоретической подвижности и плотности при электроцентрифугировании (табл. 3). Различают ЛП низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП), высокой плотности (ЛПВП), очень высокой плотности (ЛПОВП) и ЛП промежуточной плотности (ЛППП).
Отклонение в содержании какого-либо класса ЛП в крови от нормы диагностируется с нарушением липидного обмена. Например, повышенное содержание ЛПОНП сочетается с диабетом, ожирением, ишемической болезнью сердца.
Таблица 3
Классификация и свойства ЛП сыворотки крови человека
| Электрофоретическая фракция | Фракция при ультрацентрифугировании | Плотность, г/см3 | Процент белка | Липидный комплекс |
| Хиломи- кроны | - | <0,96 | 1-2 | Свободные жирные кислоты |
| Пре-b-ЛП | ЛПОНП | 0,96-1,006 | То же | |
| a2-b1-ЛП | ЛППП | 1,006-1,019 | Эфиры холестерина | |
| b-ЛП | ЛПНП | 1,019-1,063 | 21-23 | То же |
| a1-ЛП | ЛПВП | 1,063-1,200 | 35-50 | Фосфолипиды |
| a1-ЛП | ЛПОВП1 | >1,2110 | Свободные жирные кислоты | |
| Альбумин | ЛПОВП2 | >1,210 | То же |
Гликопротеиды – сложные белки, содержащие углеводы (от долей % до 80%). М.м. 15000-1000000. Присутствуют во всех тканях животных, растений, микроорганизмов. К гикопротеидам относятся белки секретов слизистых оболочек желез (муцин), опорных тканей (мукоиды), белки плазмы крови (церуллоплазмин, трансферрин, фибриноген, иммуноглобулины), интерфероны, гормоны (эритропоэтин, тиреотропин), структурные белки клеточных мембран и т.д. Все гликопротеиды выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, защитные и гормональные активизирующие действия.
Металлопротеиды – сложные белки, содержащиеся в качестве необходимой составной части атомы металлов (железо, марганец, медь, цинк и другие). В транспортных и запасающих металлопротеидах (трансферрин, церулоплазмин) связь металла с белком обычно непрочная. В состав других металлопротеидов (фермен-
тов – оксидоредуктазы, карбоангидразы) входят прочно связанные атомы металлов, удаление которых нарушает строение и функциональные свойства металлопротеидов. Многочисленные ферменты, относящиеся к металлопротеидам, требуют для проявления активности наличия в среде определенных катионов (например, маг-
ния – для фосфотрансферазы; калия, магния для пируваткиназы).
Фосфопротеиды – сложные глобулярные белки, содержащие фосфатные группы, присоединенные обычно к остаткам серина и треонина полипептидной цепи. Широко распространены в живых организмах. Выполняют разнообразные функции: участвуют в регуляции активности ядра, окислительных процессах в митохондриях, транспорте ионов в клетке. Являются ценными источниками энергетического и пластического материала в процессе эмбриогенеза и дальнейшего развития организма. К фосфопротеидам относятся казеин молока, вителлин яичного желтка, ихтулин икры рыб и др.
Вопросы и задачи
1. Перечислите основные биологические функции белков.
2. Расскажите об аминокислотном составе белков.
3. Охарактеризуйте структуру белковой молекулы.
4. Какие типы связей участвуют в формировании структуры белков?
5. Как классифицируют белки?
6. Какие компоненты входят в состав сложных белков?
7. Что такое изоэлектрическая точка белка? Какой заряд будут иметь водные растворы белка с избыточным количеством свободных карбоксильных групп?
8. Что такое денатурация белков?
9. Изобразите полную структуру следующих пептидов: Фен-Асп-Тир; Асп-Вал-Глу-Фен-Лиз.
Рекомендуемая литература
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник.– М.: Медицина, 1998. – 704 с.
2. Биохимия. Краткий курс с упражнениями и задачами / Под ред. чл.-корр. РАН, проф. Е.С. Северина, проф. А.Я. Николаева. – М.: ГЭОТАР-МЕД, 2001. – 448 с.
3. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. – Пер. с англ. – М.: Мир, 2002. 589 с.
4. Жеребцов Н.А., Попова Т.Н., Артюхов В.Г. Биохимия: Учебник. – Воронеж: Изд-во Воронежс. гос. ун-та, 2002. – 696 с.
5. Зайцев С.Ю., Конопатов Ю.В. Биохимия животных. Фундаментальные и клинические аспекты.– СПб.: Изд-во «Лань», 2004. – 384 с.
6. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2 т. – Т.1. – Пер. с англ.: – М.: Мир, 1993. – 384 с.
7. Остерман Л.А. Методы исследования белков и нуклеиновых кислот. – М.: Наука, 1981. – 285 с.
8. Справочник биохимика: Пер. с англ/ Досон Р., Эллиот Д., Эллиот У., Джонс К. – М.: Мир, 1991. – 544 с.
9. Степанов В.М. Молекулярная биология. Структура и функции белков.– М.: Высшая школа, 1996. – 335 с.
10. Уилсон Дж., Хант Т. Молекулярная биология клетки: Сб. задач. – Пер. с англ., – М.: Мир, 1994. – 520 с.
11. Физиология и биохимия сельскохозяйственных растений / Н.Н. Третьяков, Е.И. Кошкин, Н.М. Макрушин и др.; Под ред. Н.Н. Третьякова. – М.: Колос, 2000. –
640 с.
12. Эллиот В. Биохимия и молекулярная биология / В.Эллиот, Д. Эллиот; Под ред. А.И.Арчакова, М.П. Кирпичникова, А.Е. Медведева, В.П. Скулачева. – Пер. с англ. О.В. Добрыниной, И.С. Севериной, Е.Д. Скоцеляс и др. – М.: МАИК «Наука/ Интерпериодика», 2002. – 446 с.






