В состав белков входит множество различных аминокислот, отличающихся строением радикала. Природа использует в белках двадцать α-аминокислот (табл.1). α-аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (-NH2). Общая формула аминокислот: H2N – CH(R) – COOH, где R – боковая цепь (радикал).
Все разнообразие особенностей структуры и функций белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. В таблице 1 представлены формулы 20 аминокислот и трехбуквенные сокращенные обозначения, указаны также заменимые и незаменимые аминокислоты. Заменимые могут синтезироваться в организме, незаменимые не синтезируются и должны поступать с пищей.
Таблица 1
Классификация аминокислот
| № п/п | Название аминокислот | Сокращенное название | Формула | |
| I. Аминокислоты, содержащие неполярные (гидрофобные) радикалы | ||||
| 1. | Глицин | Гли | 
| |
| 2. | Аланин (незам. для детей) | Ала | 
| |
| 3. | Валин (незам.) | Вал | 
| |
| 4. | Лейцин (незам.) | Лей | 
| |
| 5. | Изолейцин (незам.) | Иле | 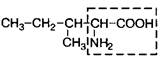
| |
| 6. | Пролин | Про | 
| |
| II. Аминокислоты, содержащие полярные (гидрофильные) радикалы | ||||
| 7. | Серин | Сер | 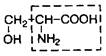
| |
| 8. | Треонин (незам.) | Тре | 
| |
| 9. | Цистеин | Цис | 
| |
| 10. | Метионин (незам.) | Мет | 
| |
| 11. | Аспарагин | Асн | 
| |
| 12. | Глутамин | Глн |
Окончание таблицы 1
| № п/п | Название аминокислот | Сокращенное название | Формула | ||
| III. Аминокислоты, содержащие ароматические радикалы | |||||
| 13. | Фенилаланин (незам.) | Фен | 
| ||
| 14. | Тирозин | Тир | 
| ||
| 15. | Триптофан (незам.) | Трп | 
| ||
| IV. Аминокислоты, содержащие отрицательно заряженные радикалы | |||||
| 16. | Аспарагиновая кислота | Асп | 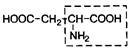
| ||
| 17. | Глутаминовая кислота | Глу | 
| ||
| V. Аминокислоты, содержащие положительно заряженные радикалы | |||||
| 18. | Лизин (незам.) | Лиз | 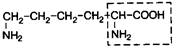
| ||
| 19. | Аргинин | Арг | 
| ||
| 20. | Гистидин (незам. для детей) | Гис | 
| ||
Классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой при физиологических значениях рН. Различают пять классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные; 5) положительно заряженные.
Для аминокислот характерна оптическая изомерия. Все природные аминокислоты обычно относятся к L-ряду (исключение составляет глицин, не имеющий хирального углеродного атома). D-формы аминокислот обнаруживаются в составе белков достаточно редко. Они выявлены в клеточной стенке некоторых бактерий, в составе некоторых антибиотиков.
В водных растворах аминокислоты находятся в виде амфотерных ионов. На ионизацию аминокислот в водных растворах большое влияние оказывает значение рН среды. В кислой среде аминокислоты заряжены положительным электрическим зарядом, в щелочной – отрицательным. Состояние аминокислоты, когда ее суммарный электрический заряд равен нулю, называется изоэлектрической точкой аминокислоты (ИЭТ). В ИЭТ амфотерные электролиты обладают минимумом растворимости, минимальной буферной емкостью.
Благодаря наличию карбоксильных и аминогрупп, аминокислоты имеют свои специфические химические реакции, нашедшие применение при разделении, идентификации и количественном определении аминокислот.
Аминокислоты способны реагировать своими карбоксильными группами со спиратами, образуя сложные эфиры:
В специфических реакциях аминокислот особую роль играет реакционная способность a-аминогруппы. Аминокислоты могут реагировать с азотистой кислотой, образуя при этом гидроксикислоту и газообразный азот:
a-Аминогруппа аминокислот может вступать с формальдегидом:
Для обнаружения, идентификации и количественного анализа широкое применение нашла цветная реакция с нингидрином:
При рН 5,5 и нагревании с избытком нингидрина аминокислота дегидрируется, декарбоксилируется с образованием СО2, NH3 и альдегида, а нингидрин превращается в восстановленный нингидрин. Нингидрин, восстановленный нингидрин и аммиак затем конденсируются с образованием окрашенного соединения, причем образуется пигмент сине-фиолетового цвета, если аминокислота содержит свободную аминогруппу, и желтый пигмент, если a - аминогруппа замещена, как например, у проилина, гидроксипролина. Интенсивность окраски можноиспользовать для колориметрического определения концентрации аминокислот, например, в белковых гидролизатах после разделения аминокислот бумажной, ионообменной хромотографией или электрофорезом.
При слабощелочных значениях рН и комнатной температуре аминокислоты вступают в реакцию с 1-фтор -2,4-нититробензолом:
Аналогичная реакция с a-аминогруппой осуществляется с фенилизотиоцианатом:






