ЖЕЛЕЗО - химический элемент; символ Fe (латинское Ferrum); атомный номер 26,относительная атомная масса 55,847. Железо - серебристо-белый металл; имеет аллотропные модификации, которые различаются по кристаллической структуре или по магнитным свойствам. До 769° С устойчиво ферромагнитное α-железо плотность 7874 кг/м3. При 769° С (точка Кюри) железо становится парамагнитным. С 911 до 1392° С устойчиво γ-железо, плотность 8000- 8100 кг/м3; с 1392 до 1539° С (температура плавления) Железо нередко называют δ-железо. Способность железо растворять углерод и другие элементы служит основой для получения разнообразных железных сплавов. Получают железо из железных руд доменным процессом (чугуны) и мартеновским, конверторным, электроплавильным процессами (стали)
Железоуглеродистые сплавы, сплавы железа с углеродом на основе железа. Варьируя состав и структуру, получают Ж. с. с разнообразными свойствами, что делает их универсальными материалами. Различают чистые Ж. с. (со следами примесей), получаемые в небольших количествах для исследовательских целей, и технические Ж. с. — стали (до 2%С) и чугуны (св. 2% С), мировое производство которых измеряется сотнями млн. т. Технические Ж. с. содержат примеси. Их делят на обычные (фосфор Р, сера S, марганец Mn, кремний Si, водород Н, азот N, кислород О), легирующие (хром Cr, никель Ni, молибден Mo, вольфрам W, ванадий V, титан Ti, кобальт Со, медь Cu и др.) и модифицирующие (магний Mg, церий Ce, кальций Ca и др.). В большинстве случаев основой, определяющей строение и свойства сталей и чугунов, является система Fe — С. Начало научному изучению этой системы положили русские металлурги П. П. Аносов (1831) и Д. К. Чернов (1868). Аносов впервые применил микроскоп при исследовании Ж. с., а Чернов установил их кристаллическую природу, обнаружил дендритную кристаллизацию и открыл в них превращения в твёрдом состоянии. Из зарубежных учёных, способствовавших созданию диаграммы состояния Fe — С сплавов, следует отметить Ф. Осмонда (Франция), У. Ч. Робертса-Остена (Англия), Б. Розебома (Голландия) и П. Геренса (Германия).
ЖЕЛЕЗОУГЛЕРОДИСТЫЕ СПЛАВЫ - сплавы Fe с С на основе Fe. Варьируя состав и структуру, получают железоуглеродистые сплавы с разнообразными свойствами, что делает их универсальными материалами. Различают чистые железоуглеродистые сплавы для исследовательских целей (со следами примесей) и технические железоуглеродистые сплавы - стали и чугуны. Технические железоуглеродистые сплавы содержат примеси, которые подразделяют: на обычные (Р, S, Mn, Si, H, N, О), легирующие (Cr, Ni, Mo, W, V, Ti, Co, Cu и др.) и модифицирующие (Mg, Ce, Са и др.). Начало научного изучения системы Fe - С положили русские металлурги П. П. Аносов и Д. К. Чернов.
Фазовые состояния Ж. с. при разных составах и температурах описываются диаграммами стабильного (рис. 1, а) и метастабильного (рис. 1, б) равновесий. В стабильном состоянии в Ж. с. встречаются жидкий раствор углерода в железе (Ж), три твёрдых раствора углерода в полиморфных модификациях железа
Основной причиной появления в Ж. с. высокоуглеродистой метастабильной фазы в виде цементита являются трудности формирования графита. Образование графита в жидком растворе Ж и твёрдых растворах a и g связано с практически полным удалением атомов железа из участков сплава, где зарождается и растет графит. Оно требует значительных атомных передвижений. Если Ж. с. охлаждаются медленно или длительно выдерживаются при повышенных температурах, атомы железа успевают удалиться из мест, где формируется графит, и тогда возникают стабильные состояния. При ускоренном охлаждении и недостаточных выдержках удаление малоподвижных атомов железа задерживается, почти все они остаются на месте, и тогда в жидких и твёрдых растворах зарождается и растет цементит. Необходимая для этого диффузия легкоподвижных при повышенных температурах атомов углерода, не требующая больших выдержек, успевает происходить и при ускоренном охлаждении. Помимо основных фаз, указанных на диаграммах, в технических Ж. с. встречаются небольшие количества и др. фаз, появление которых обусловлено наличием примесей. Часто встречаются сульфиды (FeS, MnS), фосфиды (Fe3P), окислы железа и примесей (FeO, MnO, Al2O3, Cr2O3, TiO2 и др.), нитриды (FeN, AlN) и др. неметаллические фазы. Точечными линиями на диаграммах отмечены точки Кюри, наблюдающиеся в Ж. с. в связи с магнитными превращениями феррита (768°С) и цементита (210°С).
Строение Ж. с. определяется составом, условиями затвердевания и структурными изменениями в твёрдом состоянии. В зависимости от содержания углерода Ж. с. делят на стали и чугуны. Стали с концентрацией углерода, меньшей чем эвтектоидная S' и S (табл. 2), называют доэвтектоидными, а более высокоуглеродистые — заэвтектоидными. Чугуны с концентрацией углерода, меньшей чем эвтектическая C1 и С, называют доэвтектическими, а более высокоуглеродистые — заэвтектическими.
Затвердевание сталей, содержащих до 0,5% С, начинается с выпадения кристаллов 8-раствора обычно в виде дендритов. При концентрациях углерода до 0,1% кристаллизация заканчивается образованием однофазной структуры d-раствора. Стали с 0,1—0,5% С после выделения некоторого количества 8-раствора испытывают перитектическое превращение Ж + d —> g. В интервале концентраций 0,10—0,16% С оно приводит к полному затвердеванию, а в интервале 0,16—0,50% С кристаллизация завершается при охлаждении до температуры линии IE. В Ж. с. с 0,5—4,26% С кристаллизация начинается с выделения g-раствора также в виде дендритов. Стали полностью затвердевают в интервале температур, ограниченном линиями ВС и IE, приобретая однофазную аустенитную структуру. Затвердевание же чугунов, начинаясь с выделения избыточного (первичного) g- раствора, заканчивается эвтектическим распадом остатка жидкости по одному из трёх возможных вариантов: Ж ® g + Г, Ж ®g + Ц или Ж ®(+ Г + Ц. В первом случае получаются т. н. серые чугуны, во втором — белые, в третьем — половинчатые. В зависимости от условий кристаллизации графит выделяется в виде разветвленных (рис. 2, ж) или шаровидных (рис. 2, з) включений, а цементит — в виде монолитных пластин (рис. 2, и) или проросших разветвленным аустенитом (т. н. ледебурит, рис. 2, к). В Ж. с., содержащих более 4,26—4,3% С, кристаллизация переохлажденного ниже линии D1C1 расплава в условиях медленного охлаждения начинается с образования первичного графита разветвленной или шаровидной формы. В условиях ускоренного охлаждения (при переохлаждениях ниже линии DC) образуются пластины первичного цементита (рис. 2, л). При промежуточных скоростях охлаждения выделяются и графит, и цементит. Кристаллизация заэвтектических чугунов, так же как и доэвтектических, завершается распадом остатка жидкости на смесь g- раствора с высокоуглеродистыми фазами.
Строение затвердевших Ж. с. существенно изменяется при дальнейшем охлаждении. Эти изменения обусловлены полиморфными превращениями железа, уменьшением растворимости в нём углерода, графитизацией цементита. Структура может изменяться в твёрдом состоянии в результате процессов рекристаллизации твёрдых растворов, сфероидизации кристаллов (из неравноосных становятся равноосными), коалесценции (одни кристаллы цементита укрупняются за счёт других) высокоуглеродистых фаз.
Полиморфные превращения Ж. с. связаны с перестройками гранецентрированной кубической (ГЦК) решётки g-Fe и объёмноцентрированной решётки (ОЦК) a - и d-Fe
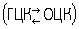
В зависимости от условий охлаждения и нагревания полиморфные превращения твёрдых растворов происходят разными путями. При небольших переохлаждениях (и перегревах) имеет место т. н. нормальная перестройка решёток железа, осуществляющаяся в результате неупорядоченных индивидуальных переходов атомов от исходной фазы к образующейся; она сопровождается диффузионным перераспределением углерода между фазами. При больших скоростях охлаждения или нагревания полиморфные превращения твёрдых растворов происходят бездиффузионным (мартенситным) путём. Решётка железа перестраивается быстрым сдвиговым механизмом в результате упорядоченных коллективных смещений атомов без диффузионного перераспределения углерода между фазами. Например, при закалке Ж. с. в воде g- раствор переходит в a- раствор того же состава. Этот пересыщенный углеродом a- раствор называют мартенситом (рис. 2, е). Превращения при промежуточных условиях могут совмещать в себе сдвиговую перестройку решётки железа с диффузионным перераспределением углерода (бейнитное превращение). Формирующиеся при этом структуры существенно различны. В первом случае образуются равноосные с малым числом дефектов кристаллы твёрдого раствора (рис. 2, а). Во втором и третьем — игольчатые и пластинчатые кристаллы (рис. 2, е) с многочисленными двойниками и линиями скольжения. Структура Ж. с. изменяется также и в связи с изменением растворимости углерода в a- и g-железе при охлаждении и нагревании. При охлаждении растворы пересыщаются углеродом и выделяются кристаллы высокоуглеродистых фаз (цементита и графита). При нагревании имеющиеся высокоуглеродистые фазы растворяются в a- и g-фазах.Зарождение и рост кристаллов цементита в пересыщенных растворах происходит обычно с большей скоростью, чем образование графита, и поэтому Ж. с. часто метастабильны. В зависимости от переохлаждения цементит, выделяющийся из твёрдого раствора, может иметь вид равноосных кристаллов, пограничной сетки, пластин и игл (рис. 2, г, д). При высокотемпературных выдержках кристаллы цементита сфероидизируются; может происходить и процесс коалесценции. Если Ж. с., содержащие цементит, длительно выдерживать при повышенных температурах, происходит графитизация — зарождается и растет графит, а цементит растворяется, Этот процесс используется при производстве изделий из графитизированной стали и ковкого чугуна (рис. 2, м). Важную роль при формировании структуры Ж. с. в твёрдом состоянии играет эвтектоидный распад т-раствора на a - раствор и высокоуглеродистую фазу. При очень малых переохлаждениях образуются феррит и графит (рис. 2, м), при небольшом увеличении переохлаждения — феррит и сфероидизированный цементит (рис. 2, г), затем (рис. 2, в) смесь феррита и цементита приобретает пластинчатое строение перлита, тем более тонкое, чем больше переохлаждение. При персохлаждениях, измеряемых сотнями градусов, эвтектоидный распад подавляется, и g- раствор превращается в мартенсит (рис. 2, е). Строение Ж. с. можно изменять в широких пределах. Основными методами управления структурой Ж. с. являются изменения химического состава, условий затвердевания, пластической деформации, термической и термомеханической обработок. Меняя фазовый состав, величину, форму, распределение и дефектность кристаллов, можно широко варьировать и свойства Ж. с. Например, важнейшие при эксплуатации Ж. с. механические свойства изменяются в следующих пределах: твёрдость от 60 до 800 HB; предел прочности 2·104—3,5·106 н/см2 (2·103—3,5·105 кгс/см2);относительное удлинение от 0 до 70%.
Титан и его сплавы
Титан по мировым запасам руды занимает следующее место после алюминия, железа и магния. Ввиду трудности получения металлического титана из руд в технике его стали применять относительно недавно. Кристаллическая решетка титана при температурах до 882 С гексагональная (а-титан), выше 882° С — кубическая объемноцентрированная (В-титан). Температура плавления чистого титана, полученного йодидным методом, составляет 1660° С. Плотность титана относительно небольшая — 4,5 г/см3. Предел прочности титана составляет около 530 Мн/м2 (53 кГ/мм2). Относительное удлинение 25%. Титан обладает высокой УНМИДР. ской стойкостью в атмосферных условиях, морской воде, многих кислотах и ш^тчах^_Ж?ф9^л^^яя стошшст-ь-его-выше,-чем у нержавеющей стали Х18Н10Т. Титан применяют в основном в хими-чесжгн~нттомышлён'н6сти) сплавы титана — в авиации, так как при небольшом удельном весе (в 1,7 легче стали) титановые сплавы почти не уступают сталям_1то_^гг)очности. "
Тематический титан~марки ВТ1 содержит 99,2% ТГ. Основные примеси: до 0,3% Fe, до 0,1% С, до 0,15% 02 и N2 (каждого элемента). Из титана ВТ1 делают листы толщиной более 0,5 мм, прутки, проволоку, поковки и штамповки* Он хорошо обрабатывается давлением в горячем состоянии. Допускает штамповку деталей несложной формы из листа в холодном состоянии. Удовлетворительно обрабатывается резанием (приблизительно так же, как аустенитные нержавеющие стали). Хорошо сваривается. Технический титан применяют для конструкций с рабочей температурой стенки до 300—350° С.
Для повышения прочности в титан добавляют хром, алюминий, ванадий и молибден. Титановый сплав ВТ5, из которого изготавливают поковки, сортовой прокат и трубы, имеет предел прочности 900 Мн/м2 (90 кГ/мм2) и условный предел текучести 800 Мн/м2 (80 кГ/мм2), т. е. выше, чем у конструкционной углеродистой стали. При нагреве до 400° С предел прочности сплава ВТ5 снижается до 500 Мн/м2 (50 кГ/мм2), предел текучести — до 400 Мн/м2 (40 кГ/мм2). Сплав обладает высокой коррозионной стойкостью во многих агрессивных средах.
Наиболее жаропрочный титановый сплав ВТ8. Из него изготавливают поковки и штамповки. В сплав ВТ8, кроме титана, входят 3% Мо и 6,3% А1. При температуре 500° С предел прочности сплава ВТ8 составляет 720 Мн/м2 (72 кГ/мм2), а условный предел текучести 570 Мн/м2 (57 кГ/мм2). Стоимость листа из титана и его сплавов выше стоимости аустенитной нержавеющей стали типа Х18Н10Т в три-четыре раза (с учетом разницы в плотности).
В энергетике титановые сплавы могут найти применение для лопаток последних ступеней мощных турбин. По прочности титановые сплавы приближаются к сталям, а плотность их существенно меньше (7,8 г/см3 у сталей и 4,5 г/см3 у титана). Основная нагрузка на выходные лопатки — от центробежных усилий. Чем меньше плотность, тем меньше эти усилия.
Алюминий и его сплавы
Алюминий — металл серебристо-белого цвета. Кристаллизуется в решетке ГЦК с периодом a = 0,4041 нм (при 20 ° С) и полиморфных превращений не испытывает. Алюминий обладает малой плотностью (2700 кг/м3), низкой температурой плавления (660 ° С), а также высокой электро- и теплопроводностью. Для алюминия характерна высокая пластичность и малая прочность.
Плотность r, (кг/м3) ∙ 10–3 - 2,7
Температура плавления Тпл, ° С - 660
Температура кипения Ткип, ° С - 2 327
Скрытая теплота плавления, Дж/г - 393,6
Теплопроводность l, Вт/м × град (при 20 ° С) - 228
Теплоемкость Ср, Дж/(г × град) (при 0–100 ° С) - 0,88
Коэффициент линейного расширения a × 106, 1/° С (при 25 ° С) - 24,3
Удельное электросопротивление r × 108, Ом× м (при 20 ° С) - 2,7
Предел прочности s в, МПа - 40–60
Относительное удлинение d, % - 40–50
Твердость по Бринеллю НВ - 25
Модуль нормальной упругости E, ГПа - 70
Алюминий обладает хорошей коррозионной стойкостью в атмосфере и среде многих органических кислот, что обусловлено образованием на его поверхности сплошной тонкой (≈ 5 нм) и плотной оксидной пленки Al2O3. В щелочных средах и некоторых неорганических кислотах алюминий быстро разрушается.
По масштабам производства и потребления алюминий занимает второе место после железа.
Отечественная промышленность выпускает первичный алюминий (ГОСТ 11069–74) трех сортов (табл. 16.1): особой чистоты (А999), высокой чистоты (А995–А95) и технической чистоты (А85–А0). В обозначении марки буква «А» означает алюминий, а последующие цифры указывают десятые, сотые и тысячные доли процента содержания алюминия. Например, алюминий марки А995 содержит не менее 99,995 % Al, марки А6 — 99,6 % Al, марки А0 — 99,0 % Al.
Алюминий особой и высокой чистоты применяется для лабораторных и специальных целей, алюминий технической чистоты — для технических целей (выпуск деформируемого полуфабриката, получения сплавов и др.).
Основные примеси в алюминии — Fe и Si. Железо и кремний практически не растворимы в твердом алюминии и образуют тройные промежуточные фазы a (Fe2SiAl6) и b (FeSiAl5), которые приводят к повышению прочности и снижению пластичности.
Классификация алюминиевых сплавов
Алюминиевые сплавы, наряду с сохранением достоинств алюминия, обладают значительно более высокой прочностью и требуемыми эксплуатационно-технологическими характеристиками.
Основными легирующими элементами в алюминиевых сплавах являются Cu, Zn, Mg, Mn, Zr. В условиях равновесия алюминиевые сплавы представляют собой равновесный твердый раствор с выделениями интерметаллидных фаз типа CuAl2
(q -фаза), Al2CuMg (S-фаза), Al6CuMg4 (Т-фаза) и др. Помимо основных элементов в сплавы вводят малые добавки Cr, Zr, Ti, Sc, V, Be и некоторые редкоземельные элементы, которые существенно влияют на кинетику распада пересыщенного твердого раствора, на процесс рекристаллизации и размер зерна, на коррозионные и технологические свойства.
Большое влияние на технологические, особенно литейные свойства, в частности на пластичность и склонность к кристаллизационным трещинам, оказывают уровень и соотношение постоянно присутствующих примесей железа и кремния. При уменьшении содержания этих примесей и, соответственно, количества грубых первичных интерметаллидов в сплавах существенно повышаются характеристики пластичности и вязкости разрушения. Поэтому для техники ответственного назначения, в том числе для авиакосмической, разработаны сплавы с жестким ограничением по примесям, которые в марке имеют обозначение «ч» — чистые; «пч» — повышенной чистоты; «оч» — особой чистоты.
Состав промышленных алюминиевых сплавов (ГОСТ 4784–97, ГОСТ 1583–93 и др.), структура и свойства изделий из них в значительной степени определяются способом производства. По способу производства алюминиевые сплавы делятся на две основные группы: деформируемые и литейные.
По способности к упрочнению термической обработкой алюминиевые сплавы подразделяются на неупрочняемые термообработкой и упрочняемые термообработкой.
Магний и его сплавы
Магний — очень легкий металл. Плотность его составляет 1,74 г/см3. Температура плавления равна 651° С. Кристаллическая решетка — гексагональная. Полиморфных превращений магний не имеет. Он легкгд окисляется на воздухе, а при повышении температуры самовоспламеняется. Предел прочности чистого магния составляет 180 Мн/м2 (18 кГ/мм2), относительное удлинение равно около 5%.
Ввиду низких коррозионной стойкости и механических свойств чистый магний в качестве конструкционного материала в технике не применяется. Для приготовления сплавов используют технический магний Мг1, содержащий 99,9% Mg и Мг2 с 99,75% Mg.
Основными легирующими элементами в сплавах на основе магния являются алюминий, цинк и марганец. Алюминий и цинк растворяются в магнии, а при содержании в количестве сверх предела растворимости образуют химические соединения. Присадка алюминия и цинка применяется для упрочнения сплавов. Благодаря ограниченной растворимости этих элементов возможна термическая обработка сплавов.
Но относительное влияние термической обработки на прочность магниевых сплавов меньше, чем на прочность алюминиевых сплавов. Для повышения коррозионной стойкости и измельчения зерна в магниевые сплавы вводят марганец.
Вредными примесями, попадающими в магниевые сплавы в процессе производства, являются натрий, калий, никель и железо.
Благодаря малой плотности магниевые сплавы находят применение в авиации и приборостроении.
Деформируемые магниевые сплавы маркируют буквами МА, например MAI, МА2 и т. д. Все магниевые деформируемые сплавы подвергают обработке давлением при 300— 400° С, так как при комнатной температуре они хрупки. Состав и механические свойства деформируемых магниевых сплавов.
Магниевые сплавы плохо переносят ударные и знакопеременные нагрузки. Они хорошо обрабатываются резанием.
Литейные магниевые сплавы уступают алюминиевым по жидкотекучести, склонности к образованию трещин и микрорыхлот. Склонность к самовозгоранию при заливке затрудняет процесс литья. Но магниевые сплавы значительно легче алюминиевых. Это весьма важно для авиации и ракетной техники и т. д. Литейные сплавы маркируют буквами МЛ (например, МЛ2,МЛ4 и др.). Многие магниевые сплавы неплохо свариваются.
Медь и ее сплавы
Медь Cu — метал красновато-розового цвета, обладает высокой тепло- и электропроводностью, пластичностью и тягучестью. Плотность ее 8,94; температура плавления 1083°С; твердость по Моосу 2,5—3. Из-за своей мягкости медь плохо обрабатывается режущим инструментом, однако хорошо полируется.
Находясь в сухом месте, медь покрывается тончайшей пленкой оксида меди, которая служит хорошей защитой от дальнейшего окисления. Во влажной среде покрывается зеленоватым напетом закиси меди, который тоже сохраняет ее о* разрушения. Медь легко растворяется в азотной кислоте и в концентрированной серной кислоте при нагревании. В соляной кислоте растворяется только в присутствии кислорода.
Медь, обладая прекрасными физическими характеристиками, широко применяется почти во всех отрасли» промышленности. В художественной промышленности медь употребляют для чеканных и филигранных работ, для изделий под эмаль и других поделок, в ювелирном производстве — для легирования сплавов благородных металлов.
Медь служит также основой для производства сплавов — латуней, бронзы, мельхиора, нейзильбера.
Латуни — медно-цинковые сплавы, содержащие до 45% цинка. Латуни значительно дешевле меди, причем, чем больше в них цинка, тем они дешевле. Латуни обладают высокими механическими свойствами: легко поддаются пластической деформации, хорошо обрабатываются режущим инструментом и полируются. На открытом воздухе неустойчивы, быстро теряют блеск, темнеют. Легко растворяются в большинстве кислот.
Плотность латуней
3 2_8,6; температура плавления 900— 1045°С; твердость по Моосу 3—4. Высокомедистые латуни — томпаки (содержание цинка до 20%) —близки по цвету к золотым сплавам. Их используют в художественной промышленности для изготовления сувенирных и спортивных значков, декоративной посуды и дешевой ювелирной галантереи.
Латуни — основной материал, используемый при обучении ювелиров. Механические свойства латуней, содержащих от 30 до 40% цинка (марки Л62, Л68), сходны со свойствами золотого сплава 583-й пробы.
Бронзы — медно-оловянистые сплавы, содержащие от 3 до 12% олова. В состав олова в зависимости от его назначения могут входить цинк, свинец, фосфор, никель. Кроме оловянистых существуют и другие бронзы — алюминиевые, кремнистые, бериллиевые, кадмиевые.
Плотность бронзы 7,5—8,8; температура плавления 1010—1140°С; твердость по Моосу 4—4,5. Оловянистые бронзы отличаются хорошими литейными свойствами. Это было замечено людьми еще в глубокой древности. И в наши дни бронза считается прекрасным материалом для художественного литья.
В художественной промышленности используется бериллиевая бронза. Она отличается высокой твердостью и упругостью, наиболее устойчива к коррозии. Применяется для изготовления юбилейных значков и. сувениров.
Мельхиор — медно-никелевый сплав с содержанием никеля от 18 до 20%. Относится к числу декоративных сплавов. Обладает красивым серебристым цветом. Отличается высокой коррозионной стойкостью. Пластичен, легко обрабатывается: штампуется, чеканится, режется, паяется полируется. Изделия из мельхиора достаточно прочны. Плотность мельхиора 8,9; температура плавления 1170°С; твердость по Моосу 3. Мельхиор — сплав, имитирующий серебро, поэтому его применяют для изготовления посуды и недорогих ювелирных изделий с полудрагоценными камнями и без камней.
Нейзильбер — трехкомпонентный сплав на медной основе, в состав которого кроме меди входят 13,5—16,5% никеля и 18— 22% цинка. Так же как и мельхиор, считается декоративным сплавом и по внешнему виду напоминает серебро. Нейзильбер дешевле мельхиора, обладает достаточной пластичностью, тягучестью, прочностью и коррозионной устойчивостью. Плотность 8,4; температура плавления 1050°С; твердость по Моосу 3. Подобно мельхиору, нейзильбер используют в художественной и ювелирной промышленности для изготовления столовых приборов и ювелирных украшений. Широкое распространение получил при изготовлении филигранных изделий.
11) ТУГОПЛА́ВКИЕ МЕТА́ЛЛЫ
ТУГОПЛА́ВКИЕ МЕТА́ЛЛЫ-металлы, имеющие температуру плавления Тпл выше температуры плавления железа (1539 °С). К ним относятся титан Ti (Тпл 1670оС), цирконий Zr (Тпл 1852оС), гафний Hf (Тпл 2222оС), ванадий V (Тпл 1900оС), ниобий Nb (Тпл 2470оС), тантал Ta (Тпл 2970оС), хром Cr (Тпл 1903оС), молибден Mo (Тпл 2620оС), вольфрам W (Тпл 3380оС), рений Re (Тпл 3180оС) и другие.
Химические свойства тугоплавких металлов схожи. Некоторая общность атомного строения определяет их физические, химические и физико-химические свойства, а, следовательно, и некоторые общие черты поведения в природе и технологии получения. Они имеют близкое электронное строение атомов и являются переходными элементами. Общность атомного строения состоит в способности атомов тугоплавких металлов отдавать электроны наружных s- и d-уровней, а также участвовать в образовании химических связей за счет частично заполненных d- и свободных р-орбиталей. В связи с этим атомы тугоплавких металлов обладают высокой активностью, которая определяет трудность сохранения ряда их соединений в стабильном состоянии. Так как межатомные связи в них очень прочные, эти металлы имеют высокую температуру плавления, повышенную механическую прочность, твердость, электрическое сопротивление. Как правило, эти металлы химически устойчивы к действию воздуха и многих агрессивных сред при низких температурах и небольшом нагревании, но становятся активными при повышенных. Поэтому при высоких температурах их эксплуатация осуществляется, как правило, в вакууме или в атмосфере инертных газов.
Эти металлы, кроме высокой температуры кипения, плавления и, соответственно, высокой температуры рекристаллизации, имеют одинаковую кристаллическую решетку — объемно-центрированную кубическую решетку (См. Структурные типы кристаллов, структура вольфрама), (кроме Re и Hf), не имеют полиморфных переходов (кроме Hf), обладают высокой плотностью выше плотности железа (кроме V и Cr) и малым коэффициентом теплового расширения (кроме V). Для металлов, имеющих ОЦК-структуру, характерно охрупчивание при определенных температурах (исключение – Ta). Температура этого перехода зависит от природы металла, его чистоты, от размера зерна и других факторов. Так как эти металлы имеют высокую температуру перехода в хрупкое состояние, то их пластическое деформирование должно проводиться в нагретом состоянии.
Из-за высокой активности тугоплавких металлов выделение их в чистом виде технологически затруднено. Производство тугоплавких металлов характеризуется многостадийностью и сложностью технологических переделов. При получении тугоплавких металлов чаще всего используются методы порошковой металлургии, используется плавка электронным или лазерным лучом, зонная плавка, плазменная обработка и другие методы.
Механические свойства полученных металлов в значительной мере зависят от их чистоты, степени деформации и условий термообработки. Металлы высокой чистоты могут быть получены химическими способами (ионная хроматография, йодидное рафинирование, дистилляция и ректификация галогенидов и других соединений металлов), электрометаллургическими (дуговая, электронно-лучевая, плазменная и лазерная плавки, зонная перекристаллизация с вытягиванием монокристаллов и др.) и электрохимическими в расплавленных средах (электролитическое рафинирование, электрохимическое восстановление галогенидов, окислов и других соединений). Механическая обработка этих металлов трудна и часто требует их подогрева.
Изделия из тугоплавких металлов, как правило, получают методами порошковой металлургии (прессованием и спекание порошков) или методами электровакуумных технологий (плавлением электронным или лазерным лучом, плазменной обработкой и др.).
Самую высокую Тпл имеет вольфрам. В связи с высокой Тпл получение вольфрама в виде компактного слитка затруднено. Характерной особенностью вольфрама, отличающего его от других металлов, является высокая внутрикристаллическая прочность при очень слабом сцеплении между отдельными зернами, Поэтому спеченные изделия, обладающие мелкозернистым строением, хрупки и легко ломаются. В результате механической обработки ковкой и волочением вольфрам приобретает волокнистую структуру и излом его весьма затруднен. Этим объясняется гибкость тонких вольфрамовых нитей. При нагревании тянутого вольфрама до высоких температур начинается процесс рекристаллизации, т. е. укрупнение зерен. Для улучшения механических свойств вольфрама различные присадки. Вольфрам обладает наименьшим температурным коэффициентом линейного расширения среди всех чистых металлов. Поэтому из него изготавливают спаи с тугоплавкими стеклами, которые тоже имеют низкий температурный коэффициент линейного расширения.
Молибден — металл, по технологии обработки близкий к вольфраму. Микроструктура спеченного, кованого и тянутого молибдена сходна со структурой аналогично обработанного вольфрама; нерекристаллизованный молибден по механическим свойствам близок к вольфраму, но в рекристаллизованном состоянии отожженный мелкозернистый молибден характеризуется высокой пластичностью. Улучшение структуры и повышение механической прочности происходит при введении специальных присадок (окиси кремния или тория и др.). Среди всех тугоплавких металлов молибден обладает наименьшим удельным сопротивлением. Высокая прочность молибдена в сочетании с хорошей пластичностью делают его одним из лучших проводниковых материалов для изготовления деталей сложной конфигурации, работающих при высоких температурах. Его используют в качестве нагревательных элементов электрических печей, Такие элементы в защитной атмосфере могут устойчиво работать при температурах 1700оС, при которых еще слабо выражены процессы рекристаллизации.
Тантал, так же как вольфрам и молибден, получают методом порошковой металлургии, процесс спекания прессованных штабиков осуществляется в вауумных печах, так как тантал поглощает газы и становится хрупким. Механические операции ковки и протяжки в отличие от вольфрама и молибдена, производят при комнатной температуре, и в отличие от вольфрама и молибдена тантал не становится хрупким при нагревании в вакууме до высоких температур. Тантал используется в вакуумной технологии в качестве испарителей при осаждении тонких пленок различных веществ, его используют при производстве конденсаторов и тонкопленочных резисторов.
Ниобий обладает высокой газопоглощающей способностью в интервале температур 400-900оС, Поэтому в электровакуумных приборах конструктивные детали из ниобия одновременно выполняли функцию нераспыляемого геттера. Среди тугоплавких металлов ниобий имеет наименьшую работу выхода электронов. Поэтому его применяют в качестве накаливаемых катодов в мощных генераторных лампах. Среди всех элементарных веществ ниобий имеет самую высокую критическую температуру перехода в состояние сверхпроводимости (9,2К). Поэтому его и соединения на его основе применяют для изготовления сверхпроводящих магнитов, СВЧ волноводов и т. д. В электровакуумной технике ниобий применяют для производства анодов, экранов и других деталей, а также для получения пленочных резисторов в микросхемах.
Платиновые металлы тоже относятся к группе тугоплавких, но по технической классификации их относят к благородным металлам.
Тугоплавкие металлы и сплавы на их основе, несмотря на дефицитность и высокую стоимость, являются основными проводниковыми материалами в электровакуумной промышленности. Они находят широкое применения в различных областях, их используют и самостоятельно, и в виде добавок в стали, работающие при высоких температурах, а также в различных сплавах, в частности, в качестве жаропрочных материалов (в самолётостроении, ракетной и космической технике, атомной энергетике, высокотемпературной технике). Применяются сплавы тугоплавких металлов, такие, как сплавы вольфрама с молибденом, молибдена с рением, вольфрама с рением, тантала с вольфрамом и др. Изменением содержания компонентов удается получать необходимые механические свойства и пластичность при заданных электрических и термических свойствах. Тугоплавкие металлы и их сплавы используются в качестве конструкционных материалов также в машиностроении, морском судостроении, электронной, электротехнической, химической, атомной промышленности и в др. отраслях техники.






