Производные тропана по биологическому действию являются экзогенными лигандами - антагонистами ацетилхолина, т.е. ж-холиноблокаторами. Блокируя ж-холинорецепторы, они делают их нечувствительными к ацетилхолину. Способность связываться с холинорецепторами объясняется структурным и геометрическим сходством алкалоидов тропана с ацетилхолином (l1 = l2):
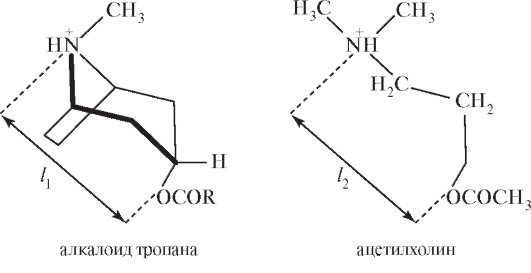
Результатом такого воздействия является: уменьшение секреции слюнных, желудочных, бронхиальных, потовых желез, поджелудочной железы; учащение сердечных сокращений; понижение тонуса гладкомышечных органов; расширение зрачка; снижение дрожания и мышечного напряжения у больных паркинсонизмом и т.д.
Однако влияние соединений этого класса на периферические ж-холинорецепторы приводит к осложнениям, что затрудняет их длительное применение.
Контроль качества
Определение подлинности. Для 2% водного раствора атропина сульфата pH от 4,5 до 6,2.
Особенностью испытания качества атропина сульфата является отсутствие оптического вращения его водного раствора (рацемат). Угол оптического вращения 10% водного раствора ЛВ должен быть от -0,05° до +0,05°.
ИК-спектр тестируемого образца атропина сульфата сравнивают со спектром стандартного образца ЛВ, используя диски с калия бромидом.
Подлинность атропина сульфата устанавливают также методом ТСХ, в качестве неподвижной фазы выступает силикагель. Состав подвижной фазы - ацетон, вода, концентрированный раствор аммиака в соотношении 90:7:3.
Методика
• Приготовление растворов.
■ Испытуемый раствор. 0,2 г исследуемой субстанции растворяют в метаноле и доводят общий объем до 10 мл.
■ Раствор сравнения (а) готовят растворением 1 мл стандартного образца атропина сульфата в метаноле общим объемом 100 мл.
■ Раствор сравнения (б) готовят растворением 5 мл раствора сравнения (а) в метаноле общим объемом 10 мл.
• На хроматографическую пластину наносят 10 мкл каждого раствора. Пластину опускают в смесь органических растворителей - подвижную фазу. После полного прекращения продвижения фронта растворителей пластину извлекают из камеры и высушивают в течение 15 мин при температуре 100-105 °С; проявитель - калия йодовисмутат K[BiI4].
• Пятно на хроматограмме, полученное с испытуемым раствором, должно быть равнозначно пятнам, полученным для растворов сравнения (а) и (б).
Как четвертичное аммониевое основание, атропина сульфат вступает в реакции с общеалкалоидными реактивами, например с пикриновой кислотой. Осадок, промытый водой и высушенный при 100- 105 °С в течение 2 ч, имеет температуру плавления от 174 до 179 °С:
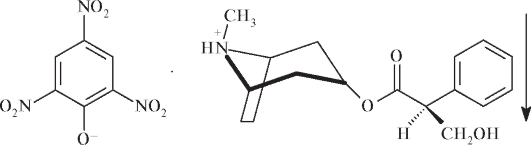
Общей реакцией на алкалоиды тропана является реакция Витали-Морена, названная по имени ученых - Витали, открывшего реакцию в 1881 г., и Морена, позднее модифицировавшего ее.
Около 1 мг субстанции выпаривают на водяной бане с концентрированной HNO3. Образовавшийся остаток растворяют в2мл ацетона и добавляют 0,1 мл 1 моль/л спиртового раствора щелочи. Появляется фиолетовое окрашивание.
Эту реакцию используют для испытания подлинности атропина сульфата, скополамина гидробромида и синтетических аналогов производных тропана.
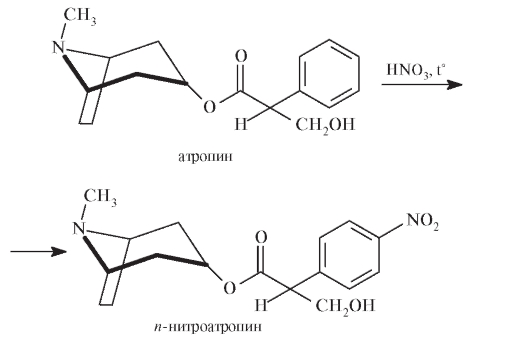
Рассмотрим возможный механизм реакции.
Атропин реагирует с концентрированной азотной кислотой при нагревании с образованием я-нитроатропина - вещества желтого цвета:
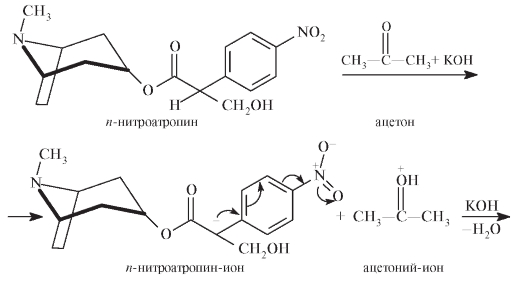
При растворении остатка после выпаривания в ацетоне с последующим добавлением щелочи происходит образование нитроната калия:
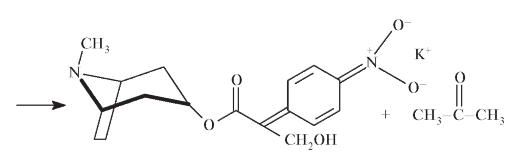
Фармакопейной реакцией подлинности атропина сульфата является реакция на ионы SO42- - осаждение нерастворимого осадка BaSO4 белого цвета:
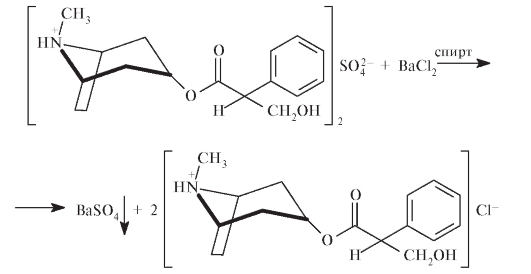
Идентифицировать атропина сульфат можно по температуре плавления основания атропина, которое медленно выделяется при прибавлении аммиака:
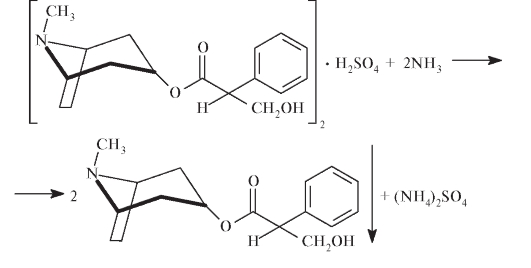
Высушенные при температуре не менее 120 °С до постоянной массы кристаллы основания атропина плавятся при 190 °С с разложением.
Испытания на чистоту. Родственные примеси в субстанции ЛВ идентифицируют методом ТСХ.
Апоатропин - недопустимая примесь в фармацевтической субстанции тропановых алкалоидов - содержит в молекуле кратную связь С=С, обусловливающую значительную реакционную способность вещества:
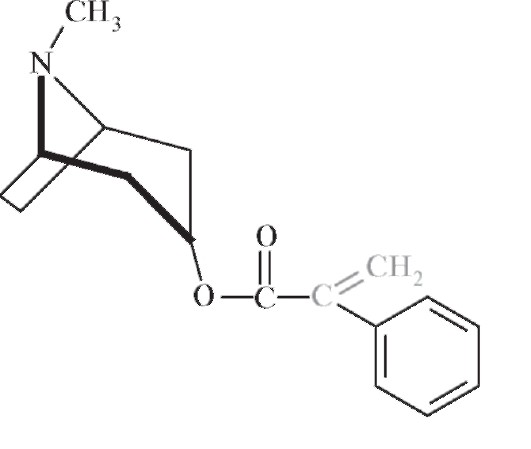
Обнаружить примесь апоатропина можно по следующей методике: к 5 мл 1,5% водного раствора атропина сульфата прибавляют 2 мл 6 моль/л раствора аммиака и энергично встряхивают. Допустимо появление легкой опалесценции, недопустимо быстрое появление мути или выделение осадка димера:
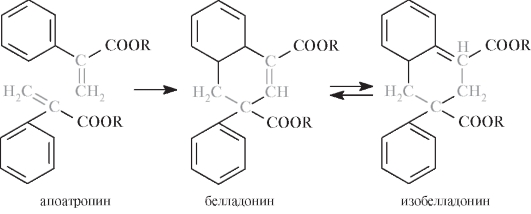
Примесь апоатропина в безводной субстанции атропина сульфата устанавливают также спектрофотометрически по поглощению при 245 нм.
• Летучие примеси - не более 4,0%.
• Сульфатная зола - не более 0,1%.
Количественное определение. Количественное определение атропина сульфата проводят титрованием в неводной среде. Для этого 0,500 г безводной субстанции атропина сульфата растворяют в 30 мл уксусно го ангидрида, при необходимости нагревают. Титруют 0,1 моль/л раствором HClO4, определяя конец титрования потенциометрически.
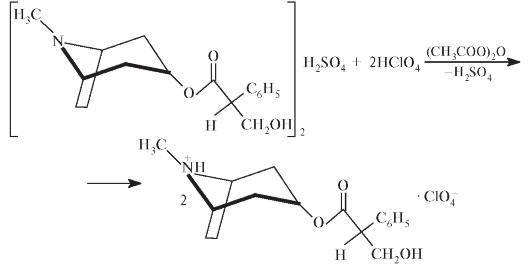
1 мл 0,1 моль/л HClO4 эквивалентен 67,68 мг C34H48N2O10S.
Определить содержание действующего вещества в атропина сульфате можно также методом кислотно-основного титрования в водноспиртовой среде с использованием титрованного раствора щелочи:

1 мл 0,05 моль/л NaOH эквивалентен 17,37 мг C34H48N2O10S • H2O.
Контрольные вопросы и задания
• Из каких структурных фрагментов состоит тропановый цикл? Какая группа является общей в связывании двух гетероциклов? Охарактеризуйте химические свойства тропана.
• Какая конформация наиболее устойчива для производных тропана? Изобразите эту форму тропанового цикла.
• Какие структурные фрагменты составляют молекулы атропина сульфата, скополамина гидробромида, кокаина гидрохлорида? Назовите их. Что собой представляют производные тропана с точки зрения их строения?
• Перечислите основные этапы синтеза тропановых алкалоидов. Напишите соответствующие уравнения на примере атропина сульфата.
• Приведите примеры реакций, подтверждающих принадлежность тропановых алкалоидов к азотистым основаниям.
• Как называется общегрупповая реакция тропановых алкалоидов? Напишите и поясните ее механизм на примере атропина сульфата. Какие ЛВ группы тропана не вступают в данную реакцию?
• Поясните причины реакции выделения основания атропина сульфата в растворе аммиака? О чем свидетельствует быстрое появление мути в смеси?
• Перечислите примеси в субстанции атропина сульфата. Дифференцируйте их на допустимые и недопустимые.
• Объясните особенность количественного кислотноосновного титрования атропина сульфата в разных средах. Какую реакцию применяют при внутриаптечном экспрессанализе?
• Согласно ФС, субстанция «Кокаина гидрохлорид» должна содержать не менее 99,0 и не более 101,1% действующего вещества в пересчете на сухое вещество. Навеску анализируемой субстанции растворяют в смеси ледяной уксусной кислоты с добавлением уксусного ангидрида. Добавляют 2 капли индикатора - кристаллического фиолетового. Титруют 0,1 моль/л раствором хлорной кислоты. Масса навески составляет m = 0,495 г, К = 1,008, Мr = 339,82.
■ Рассчитайте молярную массу эквивалента кокаина гидрохлорида.
■ Рассчитайте титр соответствия.
■ Рассчитайте теоретический объем титранта при количественном определении кокаина гидрохлорида.
■ Каково содержание действующего вещества во взятой навеске, если на титрование израсходован объем титранта V = 14,63 мл?
■ Сделать вывод о соответствии данной субстанции требованиям ФС.
• Для проведения внутриаптечного анализа поступила лекарственная форма, изготовленная по приведенной ниже прописи. При химическом контроле установлено содержание атропина сульфата m = 0,091 г, натрия хлорида - 0,098 г. Правильно ли приготовлены глазные капли? Rp: Sol. Atropini sulfatis 1% - 10 ml Sterilizetur!
Производные хинолина
ЛС, производные хинолина, относятся к следующим двум фармакологическим группам:
1) синтетические антибактериальные средства:
- препараты хинина;
- производные 4-аминохинолина (хлорохин, гидроксихлорохин, трихомонацид);
- производные 8-гидроксихинолина (хинозол, хлорхиналдол, нитроксолин - 5-НОК, энтеросептол);
- фторхинолоны - офлоксацин, ципрофлоксацин, ломефлоксацин;
2) антиаритмические средства - хинидин и хлорохин.
Хинолин и его производные являются представителями большой группы синтетических соединений и веществ растительного происхождения - алкалоидов (от араб. al-qali - щелочь). Основные свойства этих соединений обусловлены присутствием третичного атома азота (азотсодержащий гетероцикл).
В странах Южной Америки встречается дикорастущее, а в Индии культивируется хинное дерево (семейство мареновых - Rubiaceae, преимущественно двух родов: Cinchona и Remijia). В коре этого растения (в «хинной корке») насчитывается более 30 алкалоидов. Их содержание колеблется от 2 до 15%. Среди этих природных соединений - производные хинолина. Хинная корка начала применяться как целебное средство против лихорадки в начале XVII в. На рубеже XVIII-XIX вв. в медицинской практике стал использоваться препарат «хина», представляющий собой смесь неочищенных алкалоидов коры хинного дерева.
Хинолин (бензпиридин) представляет собой конденсированную систему, образованную ароматическим бензольным ядром и пиридиновым циклом:
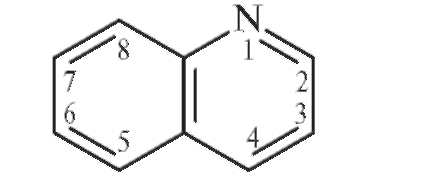
Хинолин обладает бактерицидным, антисептическим и жаропонижающим действием, но в медицине не применяется из-за высокой токсичности (низкого значения терапевтического индекса ТhI = DL50 /DE50
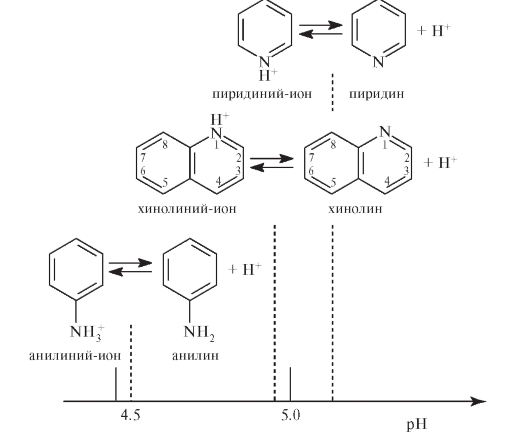
Хинолин - более сильное основание (рКВН+ = 4,9), чем анилин (рКВН+ = 4,6), и более слабое, чем пиридин (рКВН+ = 5,2). Как основание хинолин протонируется по атому азота, образуя соли с минеральными кислотами. рН-диаграммы для хинолина, пиридина и анилина демонстрируют различие в их основности:
Биологическая активность алкалоидов хинной корки зависит как от природы радикалов, так и от оптической изомерии. Применяемые в медицинской практике алкалоиды хинин и хинидин имеют одинаковое химическое строение, но являются оптическими антиподами: хинин - левовращающий, а хинидин - правовращающий изомер. В настоящее время хинин применяют в качестве противомалярийного средства, а хинидин используют как антиаритмический препарат.
Синтезированы многочисленные производные хинолина с различной фармакологической активностью.
Хинин и его соли
Основное действующее вещество хинной корки и хины - хинин, впервые было выделено в 1816 г. профессором Харьковского университета Ф.И. Гизе. После установления в 1880 г. структуры хинина и ряда других алкалоидов были синтезированы многочисленные противомалярийные и антибактериальные ЛС этого химического класса.
Таким образом, из коры хинного дерева выделяют сумму алкалоидов («хина»), среди которых содержится хинин: хинное дерево - хинная корка - хина - хинин.
Строение и свойства
Структурная основа большинства алкалоидов хинной корки содержит две гетероциклические системы - хинолин и хинуклидин:
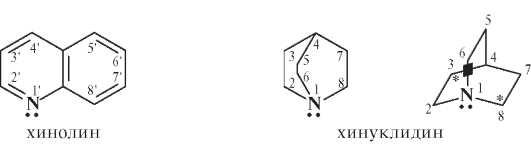
Хинуклидин - конденсированная система двух пиперидиновых циклов. При сочетании хинолина и хинуклидина образуется цинхонан, включающий, кроме того, виниловую и метиленовую группировки:
CH2 = CH - Хинуклидин - CH2 - Хинолин:
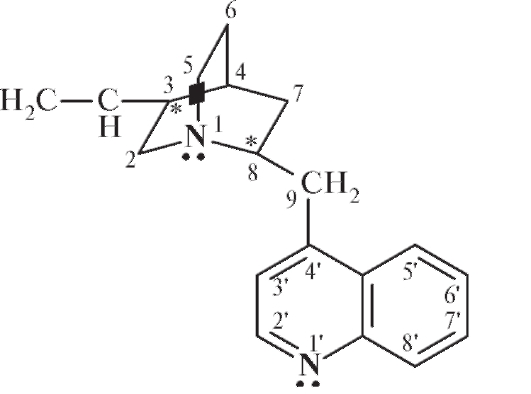
Таким образом, цинхонан состоит из хинолинового ядра, связанного через метиленовую группу с хинуклидиновым ядром, содержащим винильную группу. В хинуклидиновом фрагменте цинхонана имеется 3 асимметрических углеродных атома (3 хиральных центра).
Хинин и его правовращающий изомер хинидин-9-гидрокси-6' - метоксицинхонаны:
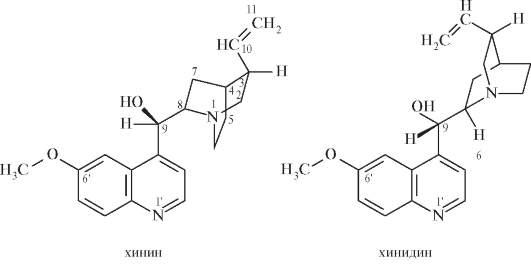
Как видно из представленных структурных формул, основой химического строения хинина и его оптического изомера хинидина является гетероциклическая система цинхонана.
Хинин - двукислотное основание и поэтому может образовывать одно- и двузамещенные соли (см. табл. 10.19). Более прочные соли образует не участвующий в системе сопряжения азот хинуклидинового цикла.
Таблица 10.19.






