Гликогенолиз – процесс анаэробного распада гликогена. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии двух ферментов: фосфорилазы а и фосфоглюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
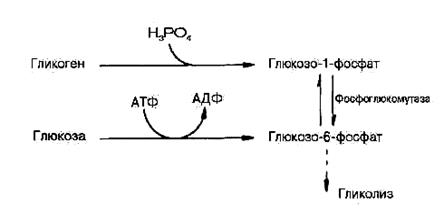
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы ATP (ATP не тратится на образование глюкозо-6-фосфата). Кажется, что энергетическая эффективность гликогенолиза выглядит несколько более высокой по сравнению с процессом гликолиза, но эта эффективность реализуется только при наличии активной фосфорилазы а. Следует иметь в виду, что в процессе активации фосфорилазы b расходуется ATP.
Гликоген-фосфорилаза катализирует последовательное удаление гликозильных остатков с невосстанавливающего конца молекулы гликогена. Ортофосфат расщепляет гликозидную связь между С1 концевого остатка и С4 соседнего остатка. Он специфически разрывает связь между углеродным атомом С1 и гликозидным атомом кислорода с сохранением α-конфигурации при С1.
Реакция, катализируемая фосфорилазой, in vitro легко обратима. При рН 6,8 равновесное отношение ортофосфата к глюкозо-1-фосфату равно 3,6. Δ G 0 для этой реакции мало, потому что гликозидная связь замещается фосфоэфирной, которая имеет почти такой же потенциал переноса. Однако in vivo фосфоролиз сдвинут далеко в сторону распада гликогена, поскольку отношение [Рi]/[Глюкозо-1-фосфат] обычно превышает 100.
Фосфорилаза скелетных мышц существует в двух взаимопревращающихся формах: активная фосфорилаза а и обычно неактивная фосфорилаза b (рис. 17.3).

Фосфорилаза b Фосфорилаза b Фосфорилаза a Фосфорилаза a
(активная (неактивная (неактивная (активная
R-форма) Т-форма) Т-форма) R-форма)
Рис. 17.3. Регуляции гликоген-фосфорилазы в скелетных мышцах
Фермент может принимать каталитически неактивную Т (напряженную) конформацию или активную R (релаксированную) конформацию. Равновесие R↔T для фосфорилазы а сдвинуто далеко в сторону активного R-coстояния. В противоположность этому фосфорилаза b находится преимущественно в неактивном Т-состоянии, исключая случаи, когда содержание AMP находится на высоком уровне, а содержание АТР и глюкозо-6-фосфата – на низком. При большинстве физиологических состояний доля активного фермента определяется скоростями фосфорилирования и дефосфорилирования. Фермент представляет собою димер, молекулярная масса субъединиц которого равна 92 кДа. Фосфорилаза b превращается в фосфорилазу а путем фосфорилирования одного остатка серина (Ser-14) в каждой субъединице. Эта ковалентная модификация катализируется специфическим ферментом киназой фосфорилазы, которая была открыта Эдмондом Фишером и Эдвином Кребсом. Фосфорилаза а инактивируется специфической фосфатазой, гидролизующей фосфорильную группу, присоединенную к Ser-14.
Мышечная фосфорилаза b активна только в присутствии высоких концентраций AMP, действующих аллостерически. AMP связывается с центром связывания нуклеотида и изменяет конформацию фосфорилазы b. ATP действует как отрицательный аллостерический эффектор, конкурируя с AMP. Глюкозо-6-фосфат также ингибирует фосфорилазу b преимущественно путем связывания с другим активным центром. При большинстве физиологических состояний фосфорилаза b неактивна вследствие ингибирующего действия АТР и глюкозо-6-фосфата. В противоположность этому фосфорилаза а полностью активна независимо от содержания AMP, ATP и глюкозо-6-фосфата. Доля активного фермента определяется, прежде всего, скоростями фосфорилирования и дефосфорилирования. В неработающей мышце почти весь фермент находится в неактивной b -форме. Повышенное содержание адреналина и электростимуляция мышцы приводят к образованию активной a -формы.
Рентгенокристаллографические исследования а- и b -форм гликоген-фосфорилазы значительно упростили изучение каталитических и регуляторных механизмов этого ключевого фермента метаболизма. Так, 841 аминокислотных остатков мономерной субъединицы компактно упакованы в три структурных домена (рис. 17.4): аминоконцевой домен (310 остатков), гликоген-связывающии домен (160 остатков) и карбоксиконцевой домен (371 остаток).
Каталитический центр локализован в глубокой щели, образованной остатками аминокислот каждого из этих трех доменов. Такая защита активного центра от водной среды должна, очевидно, благоприятствовать преобладанию фосфоролиза над гидролизом. Пиридоксальфосфат (витамин В6), который необходим для действия фермента, связывается вблизи участка присоединения глюкозо-1-фосфата. Альдегидная группа этого кофактора образует шиффово основание с лизиновой боковой цепью С-концевого домена. Сохранение ферментативной активности после восстановления шиффова основания боргидридом говорит о том, что в данном случае альдегидная группа в отличие от случаев с другими других пиридоксалевыми ферментами не участвует в катализе. В то же время фосфорильная группа пиридоксальфосфата, по-видимому, принимает прямое участие в катализе.
В молекуле фосфорилазы имеется также участок связывания гликогена, отстоящий от каталитического центра на 30 А. Этот участок имеет важное значение для присоединения фермента к частице гликогена. Благодаря такому большому расстоянию между местом связывания гликогена и каталитическим центром фермент может осуществлять фосфоролиз многих концевых остатков, не претерпевая диссоциации и реассоциации после каждого каталитического цикла.
 Рис. 17.4. α-углеродный остов фосфорилазы а
Рис. 17.4. α-углеродный остов фосфорилазы а
Помимо этого фосфорилаза содержит по меньшей мере два аллостерических участка контроля. Глюкоза и нуклеозиды, являющиеся аллостерическими ингибиторами печеночной фосфорилазы а, связываются вблизи каталитического центра. AMP, аллостерический активатор фосфорилазы b, связывается рядом с границей между субъединицами, далеко от каталитического центра и участка связывания гликогена.
Серин-14, место фосфорилирования при превращении фосфорилазы b в фосфорилазу а, также локализован вблизи границы между субъединицами. Эта фосфорильная группа в фосфорилазе а соединена водородной связью с боковой цепью аргинина-69. В то же время область, охватывающая 19 N-концевых остатков в фосфорилазе b, не имеет строго определенной структуры. Эта область b -формы по гибкости напоминает очень подвижный активационный домен в трипсиногене, который принимает строго упорядоченную конформацию при превращении в трипсин.
Активность киназы гликоген-фосфорилазы также регулируется путем ковалентной модификации. Она подобно фосфорилазе, в результате фосфорилирования превращается из формы с низкой активностью в высокоактивную форму. Фермент, катализирующий эту активацию, является компонентом системы гормон-циклический AMP.
Киназа фосфорилазы может быть частично активирована и другим путем (под действием Са2+ в концентрациях порядка 10-7 М). Этот механизм активации имеет для биологических процессов важное значение, поскольку мышечное сокращение запускается высвобождением Са2+. Таким образом, расщепление гликогена и мышечное сокращение связаны преходящим увеличением содержания Са2+ в цитоплазме.
Рассмотрим связь между гормонами, влияющими на обмен гликогена, и реакциями фосфорилирования, определяющими активности гликоген-синтазы и гликогенфосфорилазы. При этом последовательность реакций следующая:
1) адреналин связывается с плазматической мембраной мышечной клетки и стимулирует аденилатциклазу;
2) аденилатциклаза катализирует образование циклического AMP из АТР;
3) повышенное внутриклеточное содержание циклического AMP активирует протеинкиназу. В отсутствие циклического AMP эта киназа неактивна, связывание циклического AMP приводит к ее аллостерической стимуляции;
4) зависимая от циклического AMP протеинкиназа фосфорилирует киназу фосфорилазы и гликогенсинтазу. Фосфорилирование обоих ферментов лежит в основе координированной регуляции синтеза и расщепления гликогена. Оно приводит к «включению» фосфорилазы (при посредстве киназы фосфорилазы) и к одновременному «выключению» гликогенсинтазы (прямым путем).
Изменения ферментативной активности, вызываемые фосфорилированием, могут быть обращены путем гидролитического удаления фосфорильной группы. Например, превращение фосфорилазы а в фосфорилазу b катализируется фосфатазой фосфорилазы:
 |
+ Н2О ® + Р i
Ser-O-PO32- Ser-OH
Данный фермент гидролизует также фосфорильную группу активной формы киназы фосфорилазы, вызывая ее инактивацию. Кроме того, эта же фосфатаза удаляет фосфорильиую группу из гликоген-синтазы в, превращая ее в значительно более активную а -форму. Таково еще одно молекулярное устройство, обеспечивающее координированный синтез и расщепление гликогена. Активность фосфатаз также, по-видимому, регулируется. Например, сочетание Са2+ и Mg-ATP ингибирует фосфатазу фосфорилазы, но активирует киназу фосфорилазы. Фосфатаза гликоген-синтазы в мышцах и игибируется гликогеном. Поэтому при высоком содержании гликогена мышечная гликоген-синтаза будет оставаться в фосфорилированной в -форме.
Сигнал, возникающий при образовании циклического AMP, также может быть «выключен». Фосфодиэфирная связь в циклическом AMP гидролизуется специфической фосфодиэстеразой с образованием AMP, который не активирует протеинкиназу. Значение AG0 этой высокоэнергетической реакции составляет ‒ 11,9 ккал/моль.
Каскад ферментативных реакций в регуляции обмена гликогена аналогичен каскаду протеолитических реакций при свертывании крови. В обоих случаях ферментативный каскад создает высокую степень амплификации. В случае распада гликогена имеются три ферментативные стадии контроля, тогда как при синтезе гликогена таких стадий две. Если бы имела место прямая регуляция гликоген-фосфорилазы и гликоген-синтазы путем связывания адреналина, количество гормона, необходимое для усиления распада гликогена, было бы более чем в тысячу раз выше того количества, которое требуется в присутствии амплифицирующего каскада.






