Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, кристаллическом или высокоочищенном виде и свойства которых достаточно известны.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет ATP. Реакция катализируется ферментом гексокиназой:
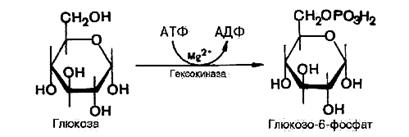
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, который служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Гексокиназа имеет высокое сродство (низкую Кm ) к своему субстрату – глюкозе; ее функция состоит в том, чтобы обеспечить захват тканью глюкозы даже при низких концентрациях последней в крови. Фосфорилируя практически всю поступающую в клетку глюкозу, гексокиназа поддерживает значительный градиент концентрации глюкозы между кровью и внутриклеточной средой. Фермент действует как на α-, так и на b-аномеры глюкозы; он фосфорилирует также и другие гексозы (в частности, D-фруктозы, D-маннозы и т.д.), но со значительно меньшей скоростью.
В печени кроме гексокиназы существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует. Функция глюкокиназы состоит в «захватывании» глюкозы из кровотока после приема пищи (когда концентрация глюкозы в крови повышается). В отличие от гексокиназы она имеет высокое значение Кm для глюкозы и эффективно функционирует при концентрации глюкозы в крови выше 100 мг/100 мл. Глюкокиназа специфична только к глюкозе.
Глюкозо-6-фосфат занимает важное положение в области стыковки ряда метаболических путей (гликолиз, глюконеогенез, пентозофосфатный путь, гликогенез и гликогенолиз).
Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:

Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы ATP:

Аналогично гексокиназной данная реакция практически необратима, протекает в присутствии ионов магния и является самой медленной реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется ATP и стимулируется АMP. При значительных величинах отношения ATP/АMP активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низка, концентрация ATP относительно высокая. Во время работы мышцы происходит интенсивное потребление ATP, активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под его влиянием фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:

Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидроксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Она катализируется ферментом триозофосфатизомеразой:

Равновесие данной изомеразной реакции сдвинуто в сторону дигидроксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глицеральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого в ходе дальнейших превращений альдегидной формы фосфотриозы дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакцию гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется ATP.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента NAD+ и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы NAD (NADH). В структурном плане фермент состоит из четырех идентичных полипептидов, образующих тетрамер. Каждый полипептид содержит по четыре SH-группы, принадлежащие остаткам цистеина. Одна из них находится в активном центре фермента. Полагают, что она принимает участие в окислении глицеральдегид-3-фосфата. Сначала субстрат соединяется с остатком цистеина дегидрогеназы, образуя тиополуацеталь, который окисляется в тиоловый эфир; атомы водорода, отщепленные при этом окислении, переносятся на связанный с ферментом NAD+. Образующийся NADH связан с ферментом менее прочно, чем NAD+, и поэтому легко замещается другой молекулой NAD+. Реакция завершается фосфоролизом тиоэфирной связи с присоединением неорганического фосфата; при этом образуются 1,3-бисфосфоглицерат и свободный фермент с SH-группой:

Потенциальная энергия процесса окисления резервируется сначала в высокоэнергетической тиоэфирной связи, а после фосфоролиза – в фосфатной связи 1,3-бисфосфоглицерата, находящейся в положении 1.
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата NAD+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования NADH глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочна и поэтому расщепляется под влиянием неорганического фосфата; при этом образуется 1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой; при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на ADP с образованием ATP и 3-фосфоглицериновой кислоты (3-фосфоглицерат):

Таким образом, благодаря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии ATP. В отличие от окислительного фосфорилирования образование ATP из высокоэнергетических соединений называется субстратным фосфорилированием.
Важной отличительной особенностью гликолиза в эритроцитах является то, что 1,3-бифосфоглицерат может превращаться в 2,3-бифосфоглицерат, который является аллостерическим эффектором, понижающим сродство гемоглобина к кислороду (рис. 17.2). Открытый в 1950 г. Рапопортом и Люберингом шунт находится под жестким контролем и снабжает эритроциты аллостерическим эффектором в таких количествах, которые диктуются метаболическим состоянием организма. При дефиците кислорода синтез 2,3-бифосфоглицерата усиливается. Эффектор связывается с четырьмя субъединицами тетрамера гемоглобина и уменьшает сродство к О2 в результате стабилизации дезоксиформы. Это в свою очередь приводит к увеличению выхода кислорода из эритроцитов в ткани и улучшению снабжения клеток кислородом.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
Реакция легкообратима, протекает в присутствии ионов Mg2+. Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:

Енолаза активируется двухвалентными катионами Mg2+ или Мn2+ и ингибируется фторидом.

Рис. 17.2. Часть системы гликолиза эритроцитов, включающей реакцию обмена NAD-NADH и 2,3-бисфосфоглицератный цикл. Условные обозначения: Альд. – альдолаза, ФГК – фосфоглицераткиназа; ФГМ – фосфоглицератмутаза; ФГФ – фосфоглицератфосфатаза; ЛДГ – лактатдегидрогеназа; ТФИ – триозофосфатизомераза.
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на ADP (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:

Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образование молочной кислоты. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента NADН, образовавшегося в шестой реакции:

Реакцией восстановления пирувата полностью завершается внутренний окислительно-восстановительный цикл гликолиза. NAD+ при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту (11-я реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитической оксидоредукции.
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачивается две молекулы ATP (гексокиназная и фосфофруктокиназная реакции). На последующих образуются четыре молекулы ATP (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет две молекулы ATP на одну молекулу глюкозы. Термодинамические характеристики реакций гликолиза представлены в табл. 17.1.
Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз, – гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также лактатдегидрогеназы и ее изоферментами.
В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1 и ЛДГ2. Они ингибируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-СоА) в цикле трикарбоновых кислот.
В тканях человека, в значительной степени использующих энергию гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
Таблица 17.1
Термодинамические характеристики реакций гликолиза
| № реакции | Реакция | ΔG0’, кДж/моль |
| Глюкоза + ATP → Глюкозо-6-фосфат + ADP + Н+ | -16,74 | |
| Глюкозо-6-фосфат ↔ Фруктозо-6-фосфат | +1,67 | |
| Фруктозо-6-фосфат + ATP → Фруктозо-1,6-дифосфат + ADP + Н+ | -14,23 | |
| Фруктозо-1,6-дифосфат → Глицеральдегид-3-фосфат + Диоксиацетонфосфат | +23,85 | |
| Диоксиацетонфосфат ↔ Глицеральдегид-3-фосфат | +7,53 | |
| Глицеральдегид-3-фосфат + NAD+Рi i ↔ 1,3-Дифосфоглицерат + NADН + Н+ | +6,28 | |
| 1,3-Дифосфоглицерат + ADP ↔ 3-Фосфоглицерат + ATP | -18,83 | |
| 3-Фосфоглицерат ↔ 2-Фосфоглицерат | +4,6 | |
| 2-Фосфоглицерат ↔ Фосфоенолпируват + Н2О | +1,67 | |
| Фосфоенолпируват + ADP + Н+ → Пируват + ATP | -31,38 |






