Установка для проведения опыта показана на рисунке 2.
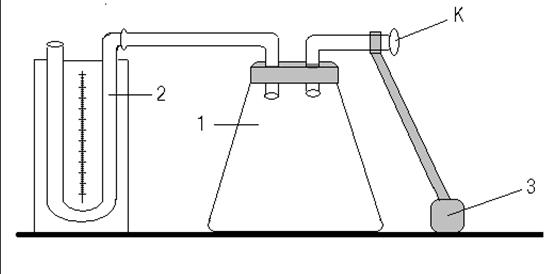
Рис. 2. Установка для определения γ методом адиабатического расширения: 1 – стеклянный сосуд, 2 – манометр, 3 – резиновая груша, К – трехходовой кран.
Большой стеклянный сосуд (баллон) постоянно соединен с открытым водяным манометром. Через трехходовой кран К к баллону подведена резиновая груша. Кран имеет три рабочих положения: «насос-баллон», «баллон-атмосфера» и «закрыто». Обозначим их условно 1, 2 и 3, соответственно. В положении 2 в баллоне устанавливается давление Р и температура Т, равные комнатным. Выделим мысленно внутри сосуда некоторую массу объемом V0. Поставим кран в положение 1, накачаем в баллон немного воздуха и закроем его, установив ручку в положение 3. При этом объем выделенной массы уменьшится, а температура повысится. Подождем, пока температура газа станет равной комнатной. Тогда выделенная масса газа будет иметь параметры Р1, V1, Т0. На диаграмме (рис. 3) это состояние обозначено цифрой 1. Откроем кран (К-3) так, чтобы давление в баллоне сравнялось с атмосферным, и снова закроем (К-2). Так как время установления равновесий давлений немного меньше соответствующего времени для температур, то процесс расширения газа в сосуде можно считать адиабатическим. Обозначим состояние выделенной массы газа после этого процесса Р0, V2, Т2. На рис. 3 это состояние обозначено цифрой 2. При адиабатическом расширении газ охладился. После того, как кран закрыли (К-3), происходит постепенное нагревание газа до комнатной температуры, и давление возрастает. Конечное состояние газа 3 имеет параметры Р2, V2, Т0. Состояния 2 и 1 связаны уравнением Пуассона PVγ = const, а состояния 1 и 3 – уравнением Бойля - Мариотта PV = const. То есть можно записать:
3 – 1: PV = const (10)
2 – 1: PVγ = const.
Р
 |


 Р1 1
Р1 1

 Р2 3
Р2 3


 Р0 2 0
Р0 2 0

V1 V2 V0 V
Рис. 3. Диаграмма состояния: 1 – первоначальное состояние, 2 – состояние после адиабатического расширения из точки 1, 3 – состояние после изохорного нагрева из точки 2.
Давление газа выражается через разность уравнений жидкости в трубах манометра следующим образом:
Р1 = Ро +ρ g Δh1 , (11)
P2 = Po + ρ g Δh2,
где ρ – плотность жидкости в манометре.
Продифференцируем (10) для перехода 3 – 1:
pdV + VdP = 0
или, с учетом изменения параметров:
P (V2 - V1) + V (P2 - P1) = 0 (12)
Продифференцируем (6) для перехода 2 – 1:
γ PdV + VdP = 0,
γ P(V2 - V1) + V (P0 - P1) = 0. (13)
Выразим из (12):
P (V2 - V1) = V (P1 - P2)
И подставим в (13):
γ V (P1 - P2) + V (P0 - P1) = 0.
Отсюда:
γ = (Р1 - Р0)/(Р1 - Р2) (14)
Что с учетом (11) дает:
γ = Δh1/(Δh1 – Δh2) (15)
Описанный метод дает не совсем точное значение γ по следующим причинам:
1. В воздухе всегда присутствуют водяные пары, которые не только понижают степень идеальности газа, но и состоят из молекул Н2О с шестью, а не с пятью степенями свободы.
2. Процесс расширения лишь весьма приближенно можно считать адиабатическим.
3. Если кран после адиабатического расширения закрыть с опозданием, то успевает начаться его изобарический нагрев.
Порядок выполнения работы
1. Поставить кран в положение 1 (K-1) и накачивать воздух в баллон до тех пор, пока разность уровней в манометре не достигнет 20 - 25 см. Закрыть кран (К-2).
2. Подождать 30 - 40 секунд, пока давление в манометре не установится на стационарном уровне, после чего записать значение разности уровней Δh1. (Если давление продолжает все время понижаться, то в установке имеется течь, которую необходимо устранить).
3. Краном соединить баллон с атмосферой (К-3) и, как только давление газа в баллоне станет равным атмосферному, сразу же поставить кран в положение «закрыто» (К-3). (Здесь надо выпускать из баллона воздух лишь 2 - 3 секунды и закрыть кран сразу же после прекращения шипения выходящего воздуха).
4. Подождать 3 - 4 минуты, пока в баллоне установится равновесное давление (температура станет равной комнатной) и записать разность уравнений манометра Δh2.
5. Повторить измерения 10 раз, изменяя величину Δh1. Результаты занести в таблицу 1.
Таблица 1.
| Δh1 | ||||||||||
| Δh2 | ||||||||||
| γ | ||||||||||
| γист |
Используя формулу (15), вычислить значения γ для каждого случая, затем найти ее среднее значение и оценить погрешность σ.
5.Контрольные вопросы
1. Дать общее определение теплоемкости, удельной и молярной теплоемкости.
2. Чему равна теплоемкость воздуха при изохорическом и изобарическом процессах, если считать его идеальным газом, в котором отсутствуют водяные пары?
3. Какой процесс называется адиабатическим? Из математического выражения для первого начала термодинамики и уравнения состояния идеального газа выведите уравнение Пуассона.
4. Прокомментируйте процессы, происходящие в эксперименте и изображенные на рис. 3. Выведите рабочую формулу (15).
5. Изобразите происходящие в эксперименте процессы в координатах:
а) Р,Т,
б) V, Т.
6. Напишите уравнение Пуассона для смеси нескольких идеальных газов, отличающихся по молекулярному весу и количеству атомов в молекуле.
7. Чему равна работа, совершаемая газом при его адиабатическом расширении? Выведите формулу и подсчитайте, как относятся величины совершаемой работы для одно-, двух-, трехатомного газа.
8. Что называется политропическим процессом? Выведите его уравнение
(уравнение политропы); получите из него уравнение адиабаты.
9. В каких пределах может меняться показатель политропы для двухатомного идеального газа?
10. Пусть имеются одно-, двух-, трехатомные идеальные газы, участвующие в различных политропических процессах, характеризующихся одной и той же теплоемкостью С. Как соотносятся между собой их показатели политропы? Предварительно выведите, чему равна теплоемкость идеального газа, участвующего в процессе, описываемом уравнением политропы.
ЛАБОРАТОРНАЯ РАБОТА 1-4






