1. Вычислите осмотическое давление раствора глюкозы при 27оС, в 4 л которого содержится 90,08 г глюкозы C6H12O6.
2. Осмотическое давление раствора, в 250 мл которого содержится 0,66 г мочевины, равно 111,1 кПа при 33 оС. Вычислите молярную массу мочевины.
3. Вычислите осмотическое давление раствора глицерина при 7оС, в 1,5 л которого содержится 276 мг глицерина C3H8O3.
4. Вычислите молярную концентрацию раствора глюкозы C6H12O6 и массу глюкозы в 200 мл раствора, осмотическое давление которого при 37оС составляет 810,4 Па.
5. Вычислите, при какой температуре осмотическое давление раствора, в 1 л которого содержится 45 мг глюкозы C6H12O6, составит 607,8 Па.
6. Вычислите осмотическое давление раствора сахарозы С12H22О11 при 20оС с массовой долей сахарозы 4%, если плотность раствора равна 1,014 г/мл.
7. Вычислите молярную концентрацию водного раствора сахарозы С12Н22О11 и массу сахарозы в 250 мл раствора, осмотическое давление которого при 7оС составляет 283,6 Па.
8. При какой температуре осмотическое давление раствора, содержащего 18,6 г анилина С6Н5NН2 в 3 л раствора, достигнет 2,84×105Па.
9. Осмотическое давление раствора, содержащего в 1 л 3,2 г неэлектролита, равно 2,42×105 Па при 20оС. Вычислите молярную массу неэлектролита.
10. Вычислите осмотическое давление раствора сахарозы при 15оС с массовой долей сахарозы С12Н22О11 равной 2,5%. Плотность раствора принять равной 1 г/мл.
11. Молярная масса неэлектролита равна 123,11 г/моль. Какая масса неэлектролита должна содержаться в 1 л раствора, чтобы раствор при 20оС имел осмотическое давление, равное 4,56×105 Па.
12. Вычислите молярную концентрацию раствора и массу сахарозы С12Н22О11 в 200 мл раствора, если осмотическое давление этого раствора при 0оС равно 6,61×105 Па.
13. Вычислите массу глюкозы С6Н12О6 в 0,5 л раствора глюкозы. Осмотическое давление этого раствора при 25оС равно давлению раствора глицерина при этой же температуре, в одном литре которого содержится 9,2 г глицерина С3Н5(ОН)3.
14. Осмотическое давление раствора, в 0,25 л которого содержится 0,66 г мочевины, равно 111439 Па при 33оС. Вычислите молярную массу мочевины.
15. Вычислите осмотическое давление раствора содержащего 46,5 г анилина С6Н5NH2 в 5 л раствора при 0оС.
16. Осмотическое давление раствора, в 2 л которого содержится 8 г неэлектролита при 27оС, равно 52672 Па. Вычислите относительную молекулярную массу неэлектролита.
17. Вычислите осмотическое давление водного раствора с массовой долей сахарозы С12Н22О1 1 10% при 20оС. Плотность раствора 1,038 г/мл.
18. Вычислите молярную концентрацию раствора сахарозы С12Н22О11 и массу растворенного вещества в 0,3 л раствора, если осмотическое давление раствора при 20оС равно 71,2 кПа.
19. Осмотическое давление раствора неэлектролита, в 50 мл которого содержится 0,18 г неэлектролита, при 0оС равно 45,38 кПа. Вычислите относительную молекулярную массу неэлектролита.
20. Вычислите осмотическое давление раствора, содержащего 16 г сахарозы в 350 г воды при 293 К. Плотность раствора считать равной 1 г/мл.
21. Осмотическое давление раствора, в 1 л которого содержится 4,65 г анилина, составляет 122,2 кПа при 21оС. Вычислите молярную массу анилина.
22. Вычислите осмотическое давление раствора сахарозы с массовой долей сахарозы С12Н22Н11 равной 1% при 30оС. Плотность раствора принять равной 1 г/мл.
23. Вычислите массу мочевины СО(NH2)2 в 1 л раствора, осмотическое давление которого при 0оС составляет 6,8.105 Па.
24. Осмотическое давление раствора в 250 мл которого содержится 11,5 г неэлектролита, равно 12,04×105 Па при 17оС. Вычислите молярную массу неэлектролита.
25. Вычислите осмотическое давление раствора, содержащего 18,4 г глицерина С3Н8О3 в 1л раствора при 0о С.
26. Осмотическое давление раствора, в 100 мл которого содержится 2,3 г неэлектролита, при 25оС равно 618,5 кПа. Вычислите относительную молекулярную массу неэлектролита.
27. Вычислите молярную концентрацию водного раствора анилина С6Н5NH2 при 20оС, если его осмотическое давление равно 432,4 кПа.
28. Осмотическое давление раствора, в 0,5 л которого содержится 2 г неэлектролита, при 0оС равно 0,51×105 Па. Вычислите относительную молекулярную массу неэлектролита.
29. Вычислите температуру водного раствора глюкозы, в 0,65 л которого содержится 18 г С6Н12О6, если осмотическое давление раствора составляет 147,5 кПа.
30. Вычислите осмотическое давление раствора анилина, в 1л которого содержится 2,79 г анилина С6Н5NH2 при 24оС.
31. Давление насыщенного пара воды при 25оС составляет 3167,2 Па. Вычислите при этой же температуре давление насыщенного пара над раствором глюкозы, содержащим 90 г глюкозы С6Н12О6 в 450 мл воды.
32. Давление насыщенного пара воды при 20оС составляет 2335,4 Па. Какую массу сахарозы С12Н22О11 следует растворить в 720 г воды для получения раствора, давление насыщенного пара которого на 18,66 Па ниже давления пара воды. Вычислите массовую долю сахарозы в растворе.
33. Давление насыщенного пара воды при 70оС составляет 31165,5 Па. Давление насыщенного пара раствора, содержащего в 270 г воды 12 г растворенного вещества при той же температуре равно 30749,6 Па. Вычислите молярную массу растворенного вещества.
34. При 420С давление насыщенного пара воды составляет 8198 Па. Вычислите понижение давления пара над раствором глюкозы при той же температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6.
35. Давление насыщенного пара воды при 100С составляет 1227,8 Па. Вычислите молярную массу неэлектролита, если при растворении 12 г его в 292 г воды при 100С понижение давления пара над раствором составило 28,4 Па.
36. Давление пара над раствором, содержащим растворенное вещество количеством 0,05 моль и воду массой 90 г равно 5267 Па при 340С. Вычислите давление насыщенного пара воды при этой температуре.
37. Вычислите давление пара при 1000С над раствором карбамида CО(NH2)2, в котором массовая доля CО(NH2)2 составляет 10%. Давление насыщенного пара воды при 1000С равно 1,0133×105 Па.
38. Вычислите молярную массу глицерина, если давление пара над раствором, содержащим 45 г глицерина в 500 г воды при 500С составляет 7246,2 Па. Давление насыщенного пара воды при 500С равно 7375,9 Па.
39. При 200С давление насыщенного пара над чистым этиловым спиртом составляет 5866,2 Па. Вычислите понижение давления пара над раствором, содержащим 30 г бензойной кислоты С6Н5СООН в 250 г этилового спирта С6Н5ОН и давление пара над раствором при 200С.
40. При 00С давление насыщенного водяного пара над льдом равно 610,5 Па. Вычислите понижение давления пара над водным раствором глицерина с массовой долей глицерина С3Н5(ОН)3 15% и давление насыщенного пара над этим раствором при 00С.
41. В ацетоне (СН3)2СО массой 50 г растворен электролит массой 5,25 г. Давление пара над раствором равно 21854 Па, а давление насыщенного пара ацетона при той же температуре составляет 23939 Па. Вычислите молярную массу растворенного вещества.
42. Понижение давления пара над раствором, содержащим 0,4 моль анилина в 3,04 кг сероуглерода, при некоторой температуре равно 1003,7 Па. Давление пара сероуглерода при той же температуре составляет 1,0133×105 Па. Вычислите молярную массу сероуглерода.
43. Давление насыщенного пара воды при 500С равно 12334 Па. Вычислите давление пара над раствором, содержащим 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды.
44. Давление насыщенного пара воды при 100С равно 1227,8 Па. В какой массе воды следует растворить метиловый спирт СН3ОН массой 16 г, чтобы понизить давление пара над раствором до 1200 Па.
45. Давление насыщенного пара воды при 700С составляет 31,165 кПа. Вычислите молярную массу растворенного вещества, если оно массой 3,52 г образует с 25,2 г воды раствор, давление насыщенного пара над которым при 700С равно 30,728 кПа.
46. Анилин C6H5NH2 массой 3,1 г растворен в 40,2 г эфира. Давление пара над полученным раствором составило 81390 Па. Вычислите относительную молекулярную массу эфира, если давление пара чистого эфира при той же температуре равно 86380 Па.
47. Вычислите давление пара над водным раствором пропилового спирта С3Н7ОН при 30оС с массовой долей С3Н7ОН равной 10%. Давление насыщенного пара растворителя при данной температуре равно 4242,84 Па.
48. При 40оС давление насыщенного пара воды составляет 7375,9 Па. Вычислите понижение давления пара над водным раствором этилового спирта С2Н5ОН с массовой долей этилового спирта равной 40% и давление насыщенного пара над этим раствором при этой же температуре.
49. Массовая доля неэлектролита в водном растворе составляет 63%. Вычислите молярную массу неэлектролита, если при 20оС давление пара над раствором равно 1399,4 Па. Давление насыщенного пара воды при данной температуре равно 2335,42 Па.
50. Вычислите давление пара над водным раствором мочевины, полученным растворением 30 г карбамида СО(NH2)2 в 550 г воды при 20оС. Давление насыщенного пара растворителя при этой температуре равно 2335,42 Па.
51. Давление пара над раствором, содержащего 155г анилина С6Н5NH2 в 201 г эфира, при некоторой температуре равно 42900 Па. Давление пара эфира при этой температуре равно 86380 Па. Вычислите молярную массу эфира.
52. Давление насыщенного пара воды при 30оС составляет 4242,84 Па. Какую массу сахарозы С12Н22О11 следует растворить в 800 г воды для получения раствора, давление пара над которым на 33,3 Па меньше давления пара воды. Вычислите массовую долю (%) сахарозы в растворе.
53. Давление пара эфира при 30оС равно 8,64.104 Па. Какое количество неэлектролита следует растворить в 50 моль эфира, чтобы понизить давление пара над раствором при данной температуре на 2666 Па.
54. Вычислите давление пара над раствором, содержащим 1,212×1023 молекул неэлектролита в 100 г воды, при 100оС. Давление насыщенного пара воды при 1000С равно 1,0133×105 Па.
55. Давление насыщенного пара воды при 65оС равно 25003 Па. Вычислите давление пара над раствором, содержащим 34,2 г сахарозы С12Н22О11 в 90 г воды при этой температуре.
56. Вычислите молярную массу неэлектролита, если давление пара над раствором, содержащем 27 г неэлектролита в 108 г воды, при 100оС равно 98775,3 Па. Давление насыщенного пара воды при 100оС равно 1,0133×105 Па.
57. Давление насыщенного пара воды при 70оС равно 31165,5 Па. Вычислите при этой же температуре понижение давления пара над раствором глюкозы С6Н12О6, в котором массовая доля глюкозы составляет 11,86 %.
58. Вычислите давление пара над раствором, содержащим 13,68 г сахарозы С12Н22О11 в 90 г воды при 65оС, если давление насыщенного пара воды при той же температуре равно 25,0 кПа.
59. Давление насыщенного пара воды при 10оС составляет 1227,8 Па. В какой массе воды следует растворить 23 г глицерина С3Н8О3 для получения раствора, давление пара над которым составляет 1200 Па при той же температуре.
60. При 0оС давление пара эфира (С2Н5)2О составляет 2465 Па. Вычислите для той же температуры давление пара над раствором анилина С6Н5NH2 в эфире с массовой долей анилина 5%.
61. Вычислите температуру кристаллизации водного раствора глюкозы, если массовая доля С6Н12О6 в растворе равна 10%. Криоскопическая константа воды 1,86.
62. Раствор, содержащий 0,512 г вещества в 100 г бензола кристаллизуется при 5,296оС. Температура кристаллизации бензола 5,5оС. Криоскопическая константа 5,1. Вычислите молярную массу растворенного вещества.
63. Раствор, содержащий 0,162 г серы в 20 г бензола кипит при температуре на 0,081оС выше, чем чистый бензол. Эбулиоскопическая константа бензола 2,57. Вычислите молярную массу серы. Сколько атомов входит в состав молекулы серы.
64. Вычислите массовую долю (%) глицерина С3Н5(ОН)3 в водном растворе, температура кипения которого 100,39оС. Эбулиоскопическая константа воды 0,52.
65. Раствор, содержащий 3,56 г антрацена С14Н10 в 100 г уксусной кислоты СН3СООН, кристаллизуется при 15,718оС. Температура кристаллизации уксусной кислоты 16,65оС. Вычислите криоскопическую константу уксусной кислоты.
66. Температура кристаллизации раствора, содержащего 66,3 г вещества в 500 г воды, равна –0,558оС. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
67. Вычислите температуру кипения раствора нафталина С10Н8 в бензоле с массовой долей С10Н8 равной 5%. Температура кипения бензола 80,2оС. Эбулиоскопическая константа бензола 2,57.
68. При растворении 15 г хлороформа в 400 г диэтилового эфира температура кипения раствора повысилась на 0,635оС. Эбулиоскопическая константа эфира 2,02. Вычислите молярную массу хлороформа.
69. Вычислите температуру кристаллизации водного раствора этилового спирта с массовой долей С2Н5ОН равной 2%. Криоскопическая константа воды 1,86.
70. Температура кристаллизации раствора, содержащего 0,1155 г белого фосфора в 19,03 г бензола, составляет 5,150С. Температура кристаллизации чистого бензола 5,40С, криоскопическая константа 5,1. Вычислите молярную массу белого фосфора. Сколько атомов входит в состав молекулы белого фосфора.
71. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86.
72. Вычислите массу нафталина С10Н8, растворенного в 8 кг бензола, если температура кристаллизации раствора составляет 3,450С. Температура кристаллизации бензола 5,40С, криоскопическая константа бензола 5,1.
73. Вычислите температуру кипения раствора нафталина, содержащего 1 г нафталина С10Н8 в 20 г эфира. Температура кипения эфира 35,60С, эбулиоскопическая константа эфира 2,16.
74. Понижение температуры кристаллизации раствора, содержащего 0,052 г камфоры в 26 г бензола равно 0,0670С. Вычислите молярную массу камфоры. Криоскопическая константа бензола 5,1.
75. Вычислите массовую долю (%) сахарозы С12Н22О11 в водном растворе, температура кристаллизации которого составляет – 0,930С. Криоскопическая константа воды 1,86.
76. Вычислите температуру кристаллизации водного раствора этилового спирта с массовой долей С2Н5ОН равной 40%. Криоскопическая константа воды 1,86.
77. Раствор, содержащий 25,65 г растворенного вещества в 300 г воды кристаллизуется при – 0,4650С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
78. Вычислите температуру кристаллизации антифриза, приготовленного из 50 г этиленгликоля С2Н4(ОН)2 и 25 г дистиллированной воды. Криоскопическая константа воды 1,86.
79. Вычислите температуру кипения водного раствора пропилового спирта с массой долей С3Н7ОН равной 5%. Эбулиоскопическая константа воды 0,52.
80. Какую массу фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,70 С. Криоскопическая константа бензола 5,1.
81. Вычислите массу воды, в которой следует растворить 0,5 кг глицерина С3Н8О3, для получения раствора с температурой кристаллизации – 30 С. Криоскопическая константа воды 1,86.
82. При растворении 2,3 г некоторого вещества в 125 г воды температура кристаллизации понижается на 0,3720С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
83. Вычислите массовую долю (%) глюкозы С6Н12О6 в водном растворе, температура кипения которого равна 100,260 С. Эбулиоскопическая константа воды 0,52.
84. Вычислите температуру кипения раствора глицерина в ацетоне с массовой долей глицерина С3Н8О3 равной 8%. Температура кипения ацетона 56,10С, эбулиоскопическая константа 1,73.
85. Температура кипения раствора, содержащего 5,4 г вещества – неэлектролита в 200 г воды, составляет 100,0780С. Вычислите молярную массу растворенного вещества. Эбулиоскопическая константа воды 0,52.
86. Вычислите массовую долю (%) сахарозы С12Н22О11 в водном растворе, температура кристаллизации которого – 0,410С. Криоскопическая константа воды 1,86.
87. Вычислите температуру кристаллизации водного раствора мочевины Co(NH2)2, в котором на 100 моль воды приходится 1 моль растворенного вещества. Криоскопическая константа воды 1,86.
88. Вычислите массу глюкозы С6Н12О6, которую следует растворить в 260 г воды для получения раствора, температура кипения которого превышает температуру кипения чистого растворителя на 0,050С. Эбулиоскопическая константа воды 0,52.
89. Вычислите массовую долю (%) метанола СН3ОН в водном растворе, температура кристаллизации которого – 2,790С. Криоскопическая константа воды 1,86.
90. Вычислите температуру кристаллизации антифриза, если в нем объемные доли этиленгликоля С2Н4(ОН)2 и воды соответственно равны 0,4 и 0,6. Для этиленгликоля r=1,116 г/мл. Криоскопическая константа воды 1,86.
91. Температура кипения раствора, содержащего 0,2 моль K2SO4 в 950 г воды повышается на 0,250С по сравнению с температурой кипения чистого растворителя. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли. Эбулиоскопическая константа воды 0,52.
92. Раствор, содержащий 0,5 моль NH4Cl в 425 г воды кристаллизуется при – 3,960С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды равна 1,86.
93. Осмотическое давление раствора KIO3 в 500 мл которого содержится 5,35 г соли равно 221 кПа при 17,50С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
94. Раствор, содержащий 16,05 г нитрата бария в 500 г воды кипит при температуре, равной 100,1220С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Эбулиоскопическая константа воды 0,52.
95. Раствор, содержащий 0,53 г Na2CO3 в 200 г воды, кристаллизуется при температуре, равной – 0,130С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
96. Раствор, содержащий 0,5 моль хлорида аммония в 425 г воды кипит при температуре на 1,100С выше, чем чистый растворитель. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Эбулиоскопическая константа воды 0,52.
97. Раствор, содержащий 0,0995 моль CaCl2 в 500 г воды кристаллизуется при – 0,740С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды равна 1,86.
98. При 300С осмотическое давление 0,05М водного раствора сульфата меди равно 182,6 кПа. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
99. При 300С осмотическое давление 0,05 М водного раствора AgNO3 равно 229,2 кПа. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
100. При растворении 1 моль хлорида натрия в 1100 г воды температура кристаллизации раствора понижается на 2,790С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды равна 1,86.
101. Температура кристаллизации 0,36 М водного раствора Na2Cr2O7 плотностью 1,066 г/мл равна – 1,70С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли. Криоскопическая константа воды равна 1,86.
102. При 300С осмотическое давление 0,05 М водного раствора Na2SO4 равно 292,2 кПа. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
103. Раствор, содержащий 55,8 г хлорида цинка в 5 кг воды кристаллизуется при температуре, равной – 0,3850С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды равна 1,86.
104. Осмотическое давление 0,2 М раствора гидроксида натрия равно 8,47×105 Па при 100С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации NaOH в растворе.
105. Раствор, содержащий 1 моль хлорида натрия в 1100 г воды кипит при 100,780С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Эбулиоскопическая константа воды 0,52.
106. Раствор, содержащий 2,1 г гидроксида калия в 250 г воды замерзает при температуре, равной – 0,5190С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации КOH в растворе. Криоскопическая константа воды 1,86.
107. Раствор, содержащий 4,388 г NaCl в 1000 г воды, кипит при 100,0740С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
108. При 00С осмотическое давление 0,1Н раствора карбоната калия (f экв = 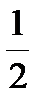 ) равно 272,6 кПа. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
) равно 272,6 кПа. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
109. Раствор, содержащий 33,2 г нитрата бария в 300 г воды, кипит при 100,4660С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Эбулиоскопическая константа воды 0,52.
110. Раствор, содержащий 25,5 г хлорида бария в 750 г воды кристаллизуется при температуре, равной – 0,7560С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды 1,86.
111. Раствор, содержащий 0,2 моль сульфата калия в 950 г воды кристаллизуется при температуре, равной – 0,880С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды 1,86.
112. Осмотическое давление 0,1 М раствора хлорида калия равно 434 кПа при 170С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
113. Раствор с массовой долей нитрата калия, равной 8,44%, кипит при температуре на 0,7970С выше по сравнению с температурой кипения воды. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
114. Температура кристаллизации 0,28 М водного раствора Cr(NO3)3 плотностью 1,017 г/мл равна 0,550С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды 1,86.
115. Осмотическое давление 0,125 М раствора бромида калия равно 5,63×105 Па при 250С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе.
116. Раствор, содержащий 4,47 г КCl в 100 г воды кристаллизуется при – 20С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. Криоскопическая константа воды 1,86.
117. Раствор, содержащий 1,7 г хлорида цинка в 250 г воды кристаллизуется при – 0,230С. Вычислите изотонический коэффициент и кажущуюся степень диссоциации ZnCl2 в этом растворе. Криоскопическая константа воды 1,86.
118. Осмотическое давление водного раствора хлорида магния с массовой долей MgCl2 0,5% равно 3,2×105 Па при 180С. Плотность раствора 1 г/мл. Вычислите изотонический коэффициент и кажущуюся степень диссоциации.
119. Вычислите изотонический коэффициент и осмотическое давление 0,01Н раствора сульфата магния (f экв = 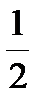 ) при 180С, если кажущаяся степень диссоциации этого электролита равна 66%.
) при 180С, если кажущаяся степень диссоциации этого электролита равна 66%.
120. Кажущаяся степень диссоциации гидроксида натрия в растворе, содержащем 4,1 г NaOH в 400 г воды равна 88%. Вычислите изотонический коэффициент и температуру кипения этого раствора. Эбулиоскопическая константа воды 0,52.
121. Вычислите молярную концентрацию ионов водорода [H+] и pH раствора, если концентрация гидроксид-ионов [OH–] (моль/л) составляет:
1) 4,0×10–10 2) 3,2×10–6 3) 7,4×10–11 4) 1,6×10–12
5) 5,0×10–6 6) 4,6×10–4 7) 2,5×10–12 8) 2,0×10–10
9) 8,4×10–3 10) 2,5×10–6 11) 6,5×10–8 12) 8,0×10–9
13) 1,4×10–3 14) 7,7×10–8 15) 2,0×10–9 16) 5,5×10–3
17) 2,5×10–9 18) 6,5×10–8 19) 2,7×10–10 20) 2,0×10–3
21) 1,4×10–12 22) 2,7×10–10 23) 4,0×10–7 24) 5,0×10–4
25) 2,0×10–2 26) 2,5×10–5 27) 6,3×10–4 28) 4,5×10–8
29) 5,0×10–10 30) 4,8×10–11
122. Вычислите pH следующих растворов сильных электролитов, принимая, что степень диссоциации электролитов равна 1:
1) 0,01 М HCl 2) 0,02 M HBr 3) 0,025 M HJ
4) 0,015 M HNO3 5) 0,005 M H2SO4 6) 0,015 M HNO3
7) 0,001 M HClO3 8) 0,002 M HClO4 9) 0,001 M LiOH
10) 0,003 M HMnO4 11) 0,004 M RbOH 12) 0,002 M HCl
13) 0,001 M NaOH 14) 0,005 M CsOH 15)0,004 M Ca(OH)2
16) 0,001 M HNO3 17) 0,003 M Sr(OH)2 18) 0,005 M HMnO4
19) 0,001 M LiOH 20) 0,005 M HClO3 21) 0,002 M NaOH
22) 0,015 M HJ 23) 0,001 M Ca(OH)2 24) 0,005 M HNO3
25) 0,01 M Ba(OH)2 26) 0,002 M H2SO4 27) 0,003 M CsOH
28) 0,004 M HCl 29) 0,003 M HClO4 30) 0,001 M Ca(OH)2
123. Вычислите степень диссоциации и pH следующих растворов слабых электролитов. Для многоосновных кислот учитывайте только первую ступень диссоциации. Напишите выражение для констант диссоциации слабого электролита по всем возможным ступеням.
1) 0,04M HBrO (k = 2,1×10–9) 2) 0,01M H2SiO3 (k1 = 2,2×10–10)
3) 0,2M HF (k = 6,6×10–4) 4) 0,02M H2CO3 (k1 = 4,5×10–7)
5) 0,005M HClO (k = 5,0×10–8) 6) 0,002M H3BO3 (k1 = 5,8×10–10)
7) 0,05M HNO3 (k = 4,6×10–4) 8) 0,08M CH3COOH (k = 1,8×10–5)
9) 0,01M H2S (k1 = 1,1×10–7) 10) 0,2M HCN (k = 7,9×10–10)
11) 0,05M NH4OH (k = 1,8×10–5) 12) 0,06M HCOOH (k = 1,8×10–4)
13) 0,02M H2Se (k1 = 1,7×10–4) 14) 0,008M H2SiO3 (k1 = 2,2×10–10)
15) 0,004M HClO (k = 5,0×10–8) 16) 0,05M HBrO (k = 2,1×10–9)
17) 0,1M H2S (k1 = 1,1×10–7) 18) 0,06M CH3COOH (k = 1,8×10–5)
19) 0,005M NH4OH (k = 1,8×10–5) 20) 0,02M H3BO3 (k1 = 5,8×10–10)
21) 0,006M HCOOH (k = 1,8×10–4) 22) 0,1M HCN (k = 7,9×10–10)
23) 0,1M H2CO3 (k1 = 4,5×10–7) 24) 0,02M HBrO (k = 2,1×10–9)
25) 0,04M HF (k = 6,6×10–4) 26) 0,02M H2SiO3 (k1 = 2,2×10–10)
27) 0,1M HNO2 (k = 4,6×10–4) 28) 0,01M HClO (k = 5,0×10–8)
29) 0,01M H3BO3 (k1 = 5,8×10–10) 30) 0,007M HAlO2 (k = 6,0×10–13)
124. Напишите уравнение гидролиза соли, вычислите константу гидролиза, степень гидролиза и pH следующих растворов солей:
1) 0,1M KClO (kHClO = 5,0×10–8)
2) 0,1M NH4Cl (kNH4OH = 1,8×10–5)
3) 0,02M KBrO (kHBrO = 2,1×10–9)
4) 0,05M KCH3COO (kCH3COOH = 1,8×10–5)
5) 0,01M NaClO (kHClO = 5,0×10–8)
6) 0,1M KNO2 (kHNO2 = 4,6×10–4)
7) 0,05M KCN (kHCN = 7,9×10–10)
8) 0,01M KF (kHF= 6,6×10–4)
9) 0,1M NaCOOH (kHCOOH = 1,8×10–4)
10) 1M NH4NO3 (kNH4OH = 1,8×10–5)
11) 0,01M NaCH3COO (kCH3COOH = 1,8×10–5)
12) 0,02M NaF (kHF= 6,6×10–4)
13) 0,04M NaNO2 (kHNO2 = 4,6×10–4)
14) 2M NH4Cl (kNH4OH = 1,8×10–5)
15) 1M KCN (kHCN = 7,9×10–10)
16) 0,001M KNO2 (kHNO2 = 4,6×10–4)
17) 0,01M NH4J (kNH4OH = 1,8×10–5)
18) 0,1M KCH3COO (kCH3COOH = 1,8×10–5)
19) 0,01M LiCOOH (kHCOOH = 1,8×10–4)
20) 0,01M NaCN (kHCN = 7,9×10–10)
21) 0,1M LiF (kHF= 6,6×10–4)
22) 0,001M RbNO2 (kHNO2 = 4,6×10–4)
23) 0,1M NaCN (kHCN = 7,9×10–10)
24) 0,001M LiCN (kHCN = 7,9×10–10)
25) 0,2M NH4Br (kNH4OH = 1,8×10–5)
26) 0,01M NaBrO (kHBrO = 2,1×10–9)
27) 0,001M LiClO (kHClO = 5,0×10–8)
28) 0,1M KJO (kHJO = 2,3×10–11)
29) 0,02M RbCH3COO (kCH3COOH = 1,8×10–5)
30) 0,001M NH4NO3 (kNH4OH = 1,8×10–5)
125. Рассчитайте произведение растворимости, если известно, что в насыщенном растворе соответствующей малорастворимой соли концентрация ионов металла равна:
| № | Название соли | Концентрация ионов металла, моль/л |
| Бромид меди (II) | 5×10-5 | |
| Ортофосфат серебра | 3×10-4 | |
| Сульфид висмута (III) | 5×10-20 | |
| Фторид свинца (II) | 4×10-3 | |
| Карбонат цинка | 3×10-6 | |
| Хромат серебра | 2×10-4 | |
| Йодат серебра | 1×10-4 | |
| Сульфид цинка | 1×10-12 | |
| Оксалат кальция | 1×10-4 | |
| Гидроксид магния | 1×10-4 |
126. Рассчитайте произведение растворимости малорастворимой соли, если в заданном объеме насыщенного раствора этой соли содержится определенное количество соли (в граммах или молях) или определенное количество граммов ионов металла:
| № | Название соли | Объем насыщенного раствора | Содержание соли или ионов металла |
| Сульфат свинца (II) | 3л | 0,132 г | |
| Йодид серебра | 3л | 0,176 г Ag+ | |
| Карбонат стронция | 5л | 0,05 г | |
| Оксалат кальция | 1л | 6,5×10-3 г | |
| Хромат бария | 1л | 3,9×10-3 г | |
| Сульфат кальция | 1л | 1,5×10-2 моль | |
| Карбонат кальция | 1л | 6,9×10-3 г | |
| Йодид свинца (II) | 0,1л | 0,0268 г Pb2+ | |
| Гидроксид магния | 1л | 2,6×10-3 г Mg2+ | |
| Гидроксид железа (II) | 0,1л | 9,5×10-5 г |
127. Рассчитайте концентрацию катионов и анионов в насыщенном растворе малорастворимой соли при данной температуре, если известно произведение растворимости:
| № | Название соли | t, 0С | Произведение растворимости |
| Йодид свинца (II) | 8,7×10-9 | ||
| Ортофосфат кальция | 1×10-25 | ||
| Карбонат меди (II) | 2,5×10-10 | ||
| Бромид свинца (II) | 6,3×10-6 | ||
| Фторид свинца (II) | 3,2×10-8 | ||
| Иодид свинца (II) | 7,47×10-9 | ||
| Хлорид свинца (II) | 1,7×10-5 | ||
| Сульфид серебра (I) | 5,7×10-51 | ||
| Сульфат серебра (I) | 7,7×10-5 | ||
| Фторид кальция | 3,95×10-11 |
128. Рассчитайте растворимость соли и выразите в моль/л и г/л. Выделится ли осадок этой соли при равных объемах следующих солей (ответ подтвердите расчетом)
| № | Название соли | Произведение растворимости | Смешиваемые растворы |
| Сульфат кальция | 6,1×10-5 | 0,02 н CaCl2 (fэкв=1/2) и 0,02 н Na2SO4 (fэкв=1/2) | |
| Сульфат серебра | 7,7×10-5 | 0,02 М AgNO3 и 1 н Н2SO4 (fэкв=1/2) | |
| Иодид свинца(II) | 8,7×10-5 | 0,1 М KJ и 0,01 н Pb(NO3)2 (fэкв=1/2) | |
| Иодид серебра | 8,5×10-17 | 0,002 М NaJ и 0,002 М AgClO4 | |
| Гидроксид железа (III) | 3,8×10-38 | 0,006 н FeCl3 (fэкв=1/3) и 0,0001 М KOH | |
| Карбонат кальция | 4,8×10-9 | 0,64 н СаCl2 (fэкв=1/2) и 0,04 н Na2СО3 (fэкв=1/2) | |
| Сульфат стронция | 2,8×10-7 | 0,15 н SrCl2 (fэкв=1/2) и 0,15 н Na2SO4 (fэкв=1/2) | |
| Фторид магния | 6,4×10-9 | 0,001 М NaF и 0,001 н MgCl2 (fэкв=1/2) | |
| Карбонат стронция | 9,42×10-10 | 0,02 н SrCl2 (fэкв=1/2) и 1 н Na2СО3 (fэкв=1/2) | |
| Карбонат бария | 8,0×10-9 | 0,01 н ВаCl2 (fэкв=1/2) и 0,06 н К2СО3(fэкв=1/2) |






