1. Рассчитайте массу растворенного вещества и объем растворителя (для раствора с заданной массовой долей) в задачах с №1 – №26; и объем более концентрированного раствора в задачах №27 – №56, необходимых для приготовления растворов. Плотности растворов приведены в приложении 3. Опишите методику приготовления данных растворов:
1. 0,8 л раствора с массовой долей хлорида железа (III) 5% (rраствора = 1049 кг/м3), исходя из кристаллогидрата FeCl3×7H2O.
2. 0,65 л раствора с массовой долей сульфата меди (II) 8% (rраствора = 1084 кг/м3), исходя из кристаллогидрата CuSO4×5H2O.
3. 0,8 л раствора с массовой долей карбоната натрия 2% (rраствора = 1019 кг/м3), исходя из кристаллогидрата Na2CO3×10H2O.
4. 0,75 л раствора с массовой долей сульфата магния 6% (rраствора = 1060 кг/м3), исходя из кристаллогидрата MgSO4×7H2O.
5. 800 мл раствора с массовой долей хлорида бария 6% (rраствора = 1053 кг/м3), исходя из кристаллогидрата ВаCl2×2H2O.
6. 1,2 л раствора с массовой долей сульфата натрия 6% (rраствора = 1053 кг/м3), исходя из кристаллогидрата Na2SO4×10H2O.
7. 700 мл раствора с массовой долей хлорида меди (II) 8% (rраствора = 1076 кг/м3), исходя из кристаллогидрата СuCl2×2H2O.
8. 500 мл 0,1 н. раствора Cu(NO3)2 (fэкв =  ), исходя из кристаллогидрата Cu(NO3)2×3H2O.
), исходя из кристаллогидрата Cu(NO3)2×3H2O.
9. 200 мл 0,2 н. раствора FeSO4 (fэкв =  ), исходя из кристаллогидрата FeSO4×7H2O.
), исходя из кристаллогидрата FeSO4×7H2O.
10. 250 мл 0,5 н. раствора FeSO4 (fэкв =  ), исходя из кристаллогидрата FeSO4×9H2O.
), исходя из кристаллогидрата FeSO4×9H2O.
11. 500 мл 0,2 н. раствора NiSO4 (fэкв =  ), исходя из кристаллогидрата NiSO4×7H2O.
), исходя из кристаллогидрата NiSO4×7H2O.
12. 200 мл 0,2 н. раствора СoCl2 (fэкв =  ), исходя из кристаллогидрата СoCl2×6H2O.
), исходя из кристаллогидрата СoCl2×6H2O.
13. 500 мл 0,3 н. раствора MgSO4 (fэкв =  ), исходя из кристаллогидрата
), исходя из кристаллогидрата
MgSO4 ×6H2O.
14. 500 мл 0,25 н. раствора MgCl2 (fэкв =  ), исходя из кристаллогидрата MgCl2×6H2O.
), исходя из кристаллогидрата MgCl2×6H2O.
15. 200 мл 0,1 н. раствора ZnSO4 (fэкв =  ), исходя из кристаллогидрата ZnSO4×7H2O.
), исходя из кристаллогидрата ZnSO4×7H2O.
16. 250 мл 0,2 н. раствора AlCl3 (fэкв = 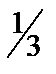 ), исходя из кристаллогидрата AlCl3×6H2O.
), исходя из кристаллогидрата AlCl3×6H2O.
17. 500 мл 0,25 н. раствора Al2(SO4)3 (fэкв = 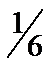 ), исходя из кристаллогидрата Al2(SO4)3 ×18H2O.
), исходя из кристаллогидрата Al2(SO4)3 ×18H2O.
18. 200 мл 0,2 М раствора сульфата калия-алюминия, исходя из кристаллогидрата KAl(SO4)2×12H2O.
19. 200 мл 0,02 М раствора сульфата калия-хрома, исходя из кристаллогидрата KCr(SO4)2×12H2O.
20. 500 мл 0,05 н. раствора CаCl2 (fэкв =  ), исходя из кристаллогидрата CаCl2 ×6H2O.
), исходя из кристаллогидрата CаCl2 ×6H2O.
21. 0,5 л 0,025 М раствора сульфата магния, исходя из кристаллогидрата MgSO4×7H2O.
22. 250 мл 0,05 М раствора тиосульфата натрия, исходя из кристаллогидрата Na2S2O3×5H2O.
23. 500 мл 0,05 М раствора хлорида кальция, исходя из кристаллогидрата СaCl2×6H2O.
24. 500 мл 0,03 М раствора карбоната натрия, исходя из кристаллогидрата Na2CO3×10H2O.
25. 1 л 0,05 М раствора хлорида алюминия, исходя из кристаллогидрата AlСl3×6H2O.
26. 200 мл 0,05 М раствора сульфата натрия, исходя из кристаллогидрата Na2SO4×10H2O.
27. 1,2 л раствора с массовой долей серной кислоты 20% из раствора с массовой долей H2SO4 92%.
28. 0,6 л раствора с массовой долей серной кислоты 12% из раствора с массовой долей кислоты 60%.
29. 0,5 л 0,1 н. раствора фосфорной кислоты (fэкв = 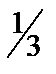 ) из раствора с массовой долей H3РO4 49% и плотностью – 1330 кг/м3.
) из раствора с массовой долей H3РO4 49% и плотностью – 1330 кг/м3.
30. 1 л 0,2 н. раствора хлороводородной кислоты (fэкв = 1) из раствора с массовой долей HСl 12%.
31. 0,5 л 0,25 н. раствора серной кислоты (fэкв =  ) из раствора с массовой долей H2SO4 96%.
) из раствора с массовой долей H2SO4 96%.
32. 0,2 л 0,3 М раствора хлороводородной кислоты из раствора с массовой долей HСl 20%.
33. 0,5 л 0,25 н. раствора сульфата магния (fэкв =  ) из раствора с массовой долей соли 20% и плотностью 1310 кг/м3.
) из раствора с массовой долей соли 20% и плотностью 1310 кг/м3.
34. 0,5 л 0,03 н. раствора хлорида бария (fэкв =  ) из раствора с массовой долей соли 15% и плотностью 1147кг/м3.
) из раствора с массовой долей соли 15% и плотностью 1147кг/м3.
35. 1 л 0,05 М раствора азотной кислоты из раствора с массовой долей кислоты 32%.
36. 250 мл 0,25 М раствора фосфорной кислоты из раствора с массовой долей фосфорной кислоты 40% и плотностью 1254 кг/м3.
37. 0,6 л раствора с массовой долей гидроксида натрия 16% из раствора с массовой долей NaOH 40%.
38. 0,8 л раствора с массовой долей азотной кислоты 12% из раствора с массовой долей кислоты 56%.
39. 0,75 л раствора с массовой долей хлороводородной кислоты 8% из раствора с массовой долей кислоты 36%.
40. 1,2 л раствора с массовой долей серной кислоты 12% из раствора с массовой долей кислоты 60%.
41. 0,5 л 0,1 М раствора азотной кислоты из раствора с массовой долей кислоты 32%.
42. 0,5 л 2 н. раствора серной кислоты (fэкв =  ) из раствора с массовой долей кислоты 92%.
) из раствора с массовой долей кислоты 92%.
43. 0,2 л 0,4 н. раствора серной кислоты (fэкв =  ) из раствора с массовой долей кислоты 32%.
) из раствора с массовой долей кислоты 32%.
44. 250 мл 0,2 М раствора гидроксида натрия из раствора с массовой долей NaOH 12%.
45. 0,5л 0,2 М раствора нитрата калия из раствора с массовой долей KNO3 70% и плотностью 1600 кг/м3.
46. 0,5 л 1,5 М раствора хлороводородной кислоты из раствора с массовой долей кислоты 36%.
47. 0,75 л раствора с массовой долей гидроксида калия 12% из раствора с массовой долей КOH 40%.
48. 1 л 0,02 М раствора хлороводородной кислоты из раствора с массовой долей кислоты 36%.
49. 500 мл 0,2 М раствора гидроксида калия из раствора с массовой долей КOH 36%.
50. 1 л 0,6 М раствора хлороводородной кислоты из раствора с массовой долей кислоты 28%.
51. 0,5 л 0,2 н. раствора карбоната натрия (fэкв =  ) из раствора с массовой долей соли 10% и плотностью 1103 кг/м3.
) из раствора с массовой долей соли 10% и плотностью 1103 кг/м3.
52. 0,5 л 0,02 М раствора хлорида алюминия из раствора с массовой долей соли 20% и плотностью 1157 кг/м3.
53. 100 мл 0,05 н. раствора хлорида цинка (fэкв =  ) из раствора с массовой долей соли 20% и плотностью 1186 кг/м3.
) из раствора с массовой долей соли 20% и плотностью 1186 кг/м3.
54. 0,2 л 0,5 н. раствора сульфата меди (fэкв =  ) из раствора с массовой долей CuSO4 16% и плотностью 1180 кг/м3.
) из раствора с массовой долей CuSO4 16% и плотностью 1180 кг/м3.
55. 250 мл 0,5 М раствора гидроксида калия из раствора с массовой долей КOH 36%.
56. 0,5 л 0,5 н. раствора серной кислоты (fэкв =  ) из раствора с массовой долей кислоты 80%.
) из раствора с массовой долей кислоты 80%.
2. Вычислите массовую долю растворенного вещества; молярную концентрацию; молярную концентрацию эквивалента; моляльность и титр для:
1. Раствора карбоната натрия, если в 100 мл его содержится 10 г этой соли (плотность раствора 1100 кг/м3).
2. Раствора с массовой долей серной кислоты 20%.
3. Раствора хлорида натрия, если в 200 мл его содержится 20 г этой соли (плотность раствора 1070 кг/м3).
4. Раствора с массовой долей хлороводородной кислоты 20%.
5. Раствора сульфата меди (II), если в 300 мл его содержится 5 г этой соли (плотность раствора 1010 кг/м3).
6. Раствора с массовой долей ортофосфорной кислоты 20%, плотность которого 1200 кг/м3.
7. Раствора с массовой долей азотной кислоты 28%.
8. Раствора азотной кислоты, в 4 л которого содержится 932 г кислоты (плотность раствора 1120 кг/м3).
9. Раствора, который содержит в 3 л 175,5 г карбоната калия (плотность раствора 1414 кг/м3).
10. Раствора с массовой долей азотной кислоты 40%.
11. Раствора с массовой долей ортофосфорной кислоты 40%, плотность которого 1254 кг/м3.
12. Раствора гидроксида калия, если в 1 кг воды растворено 666 г гидроксида калия.
13. Раствора хлорида алюминия, если в 200 мл его содержится 32 г соли (плотность раствора 1149 кг/м3).
14. 10 н. раствора серной кислоты (fэкв =  ), плотностью 1290 кг/м3.
), плотностью 1290 кг/м3.
15. 0,8 М раствора сульфата железа (III), если плотность раствора 1241 кг/м3.
16. 8 М раствора азотной кислоты, плотность которого 1246 кг/м3.
17. Раствора с массовой долей сульфата меди (II) 16% и плотностью 1180 кг/м3.
18. Раствора хлорида натрия, содержащего в 0,75 литре 8,82 г соли (плотность раствора 1012 кг/м3).
19. Раствора гидроксида натрия, если в 0,5 л раствора плотностью 1023 кг/м3 содержится 10 г гидроксида натрия.
20. Раствора, в 100 мл которого содержится 22,6 г серной кислоты (плотность раствора 1143 кг/м3).
21. Раствора серной кислоты, если титр его 0,0195 г/мл (плотность раствора 1143 кг/м3).
22. Раствора с массовой долей хлорида цинка 20%, плотность которого 1186 кг/м3.
23. Раствора ортофосфорной кислоты, полученной при растворении 18 г кислоты в 282 мл воды, если плотность его 1031 кг/м3.
24. 1,4 М раствора нитрата серебра, плотность которого 1128 кг/м3.
25. Раствора азотной кислоты, если в 3 л его содержится 316 г кислоты (плотность раствора 1054 кг/м3).
26. Раствора с массовой долей хлорида кальция 20% и плотностью 1178 кг/м3.
27. Раствора серной кислоты, если в 1 л раствора содержится 57,7 г этой кислоты (плотность раствора 1035 кг/м3).
28. Раствора с массовой долей гидроксида бария 7% и плотностью 1040 кг/м3.
3. Выполните расчеты, связанные с переходом от одной концентрации к другой
1. Какой объем 1,2 М раствора карбоната натрия нужно взять для приготовления 3 л 0,3 н. раствора Na2CO3 (fэкв =  )?
)?
2. Сколько воды следует добавить к 0,2 л 2 М раствора фосфорной кислоты для получения 0,5 н. раствора Н3РО4 (fэкв = 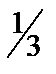 )?
)?
3. Какой объем 2,5 н. раствора гидроксида калия (fэкв = 1) следует взять для приготовления 1,5 л 0,1 М раствора?
4. Сколько воды следует добавить к 300 мл 0,8 М раствора хлорида кальция для получения 0,2 н. раствора СaCl2 (fэкв =  )?
)?
5. Сколько воды необходимо прибавить к 200 мл раствора с массовой долей серной кислоты 20%, чтобы получить раствор с массовой долей кислоты 5%?
6. К 0,8 л раствора с массовой долей гидроксида натрия 32% прибавлено 0,4 л раствора с массовой долей NaOH 16%. Определить массовую долю NaOH в полученном растворе.
7. Сколько граммов раствора с массовой долей нитрата серебра 5% требуется для обменной реакции с 120 мл 0,6 М раствора хлорида аммония?
8. Какой объем 2 М раствора карбоната натрия необходимо взять для приготовления 1 л 0,25 н. раствора Na2CO3 (fэкв =  )?
)?
9. Смешаны 300 мл 2 М раствора гидроксида калия и 1,2 л раствора с массовой долей гидроксида калия 12%. Чему равна молярная концентрация эквивалента полученного раствора?
10. Какова масса гидроксида алюминия, если для его растворения потребовалось 0,2 л раствора с массовой долей азотной кислоты 30%?
11. Вычислите массовую долю хлороводородной кислоты в растворе, полученном при смешении 150 мл раствора с массовой долей HCl 20% и 300 мл раствора с массовой долей HCl 32%.
12. Из 750 г раствора с массовой долей серной кислоты 48% выпарили 300 г воды. К оставшемуся раствору прилили 45 г раствора с массовой долей кислоты 92 %. Определить массовую долю H2SO4 в полученном растворе.
13. Сколько воды надо прибавить к 1,5 кг раствора с массовой долей растворенного вещества 35%, чтобы получить раствор с массовой долей растворенного вещества 20%?
14. Для приготовления раствора с массовой долей растворенного вещества 13% к 4 кг раствора с массовой долей его вещества 69% прилили воду. Сколько израсходовано воды и сколько получено раствора?
15. К 7 л раствора с массовой долей азотной кислоты 20% прилили воду до получения раствора с массовой долей HNO3 3%. Определить объем добавленной воды и массу полученного раствора.
16. Смешали 1 л раствора с массовой долей хлороводородной кислоты 20% и 1 л раствора с массовой долей хлороводородной кислоты 12%. Какова массовая доля HCl в полученном растворе?
17. Смешали 50 мл раствора с массовой долей серной кислоты 52% и 50 мл раствора с массовой долей серной кислоты 4%. Какова массовая доля H2SO4 и молярная концентрация эквивалента полученного раствора?
18. Сколько граммов раствора с массовой долей гидроксида натрия 2,5% можно приготовить из 80 мл раствора с массовой долей NaOH 36%?
19. К 800 мл 3 М раствора NaOH добавили такой же объем раствора с массовой долей гидроксида натрия 12%. Чему равна молярная концентрация полученного раствора?
20. К 300 мл раствора с массовой долей карбоната натрия 18% (плотность 1190 кг/м3) добавили 500 мл раствора с массовой долей серной кислоты 8%. Сколько граммов карбоната натрия не прореагировало с кислотой?
21. Каким объемом раствора с массовой долей гидроксида калия 28% можно заменить 600 мл 7,5 М гидроксида натрия?
22. Смешаны 3 л 0,1 М раствора фосфорной кислоты с 2 л раствора с массовой долей той же кислоты 9% (плотность 1050 кг/м3). Вычислить молярную концентрацию эквивалента полученного раствора.
23. Какой объем 0,1 М раствора фосфорной кислоты можно приготовить из 75 мл 0,75 н. раствора Н3РО4 (fэкв = 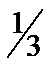 )?
)?
24. Каким объемом 4 н. раствора серной кислоты (fэкв =  ) можно полностью разложить 0,65 л раствора с массовой долей карбоната калия 20% (плотность 1189 кг/м3)?
) можно полностью разложить 0,65 л раствора с массовой долей карбоната калия 20% (плотность 1189 кг/м3)?
25. Смешали 100 мл раствора с массовой долей серной кислоты 52% и 100 мл раствора с массовой долей этой же кислоты 12% и добавили воды до 3 л. Определите молярную концентрацию эквивалента полученного раствора.
4. Выполните вычисления с использованием молярной концентрации эквивалента
1. Для нейтрализации 40 мл 0,1 н. раствора серной кислоты (fэкв =  ) потребовалось 16 мл раствора гидроксида натрия. Сколько граммов гидроксида натрия содержит 1 л этого раствора?
) потребовалось 16 мл раствора гидроксида натрия. Сколько граммов гидроксида натрия содержит 1 л этого раствора?
2. На нейтрализацию 20 мл раствора NaOH израсходовано 12 мл 0,5 н. раствора серной кислоты (fэкв =  ). Какова молярная концентрация эквивалента раствора щелочи? Сколько 0,25 М хлороводородной кислоты потребовалось бы для той же реакции?
). Какова молярная концентрация эквивалента раствора щелочи? Сколько 0,25 М хлороводородной кислоты потребовалось бы для той же реакции?
3. Какой объем 0,4 М раствора хлороводородной кислоты можно нейтрализовать прибавлением 800 мл 0,25 М раствора гидроксида натрия? Сколько граммов гидроксида натрия содержится в 0,5 л 0,25 М раствора?
4. Для нейтрализации 80 мл 0,5 н. раствора серной кислоты (fэкв =  ) израсходовано 10 мл раствора гидроксида калия. Сколько граммов гидроксида калия содержится в 2 л этого раствора?
) израсходовано 10 мл раствора гидроксида калия. Сколько граммов гидроксида калия содержится в 2 л этого раствора?
5. К 250 мл 1,6 н. раствора серной кислоты (fэкв =  ) добавили 400 мл 0,35 М раствора гидроксида натрия. Сколько мл 0,25 н. раствора гидроксида натрия дополнительно требуется для нейтрализации раствора?
) добавили 400 мл 0,35 М раствора гидроксида натрия. Сколько мл 0,25 н. раствора гидроксида натрия дополнительно требуется для нейтрализации раствора?
6. Для нейтрализации 20 мл раствора серной кислоты израсходовано 25 мл 0,5 М раствора гидроксида натрия. Найти молярную концентрацию и молярную концентрацию эквивалента раствора кислоты.
7. До какого объема следует упарить 3,5 л 0,04 М раствора гидроксида калия для получения 0,1 М раствора?
8. До какого объема следует разбавить водой 2,4 л 1,8 н. раствора серной кислоты (fэкв =  ) для получения 0,25 н. раствора H2SO4 (fэкв =
) для получения 0,25 н. раствора H2SO4 (fэкв =  )?
)?
9. Определить количество гидроксида кальция, содержащегося в 400 мл раствора, если на нейтрализацию 24 мл этого раствора израсходовано 10 мл 0,02 М раствора хлороводородной кислоты.
10. Сколько воды необходимо прибавить к 200 мл 1 н. раствора H2SO4 (fэкв =  ), чтобы получить 0,05 н. раствор H2SO4 (fэкв =
), чтобы получить 0,05 н. раствор H2SO4 (fэкв =  )?
)?
11. Сколько граммов H2SO4 содержит один литр раствора, если на нейтрализацию 15 мл раствора было затрачено 20 мл 0,1 М раствора гидроксида натрия?
12. Сколько граммов гидроксида натрия содержится в 400 мл 0,12 М раствора? Сколько мл этого раствора потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 30 мл 0,4 н. раствора FeCl3 (fэкв = 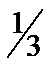 )?
)?
13. Какой объем 0,01 М раствора нитрата серебра потребуется для реакции обмена с 1 мл раствора хлорида натрия с массовой долей 10% и плотностью 1073 кг/м3?
14. На реакцию с хлоридом калия, содержащимся в 10 мл раствора, израсходовано 45 мл 0,02 М раствора нитрата серебра. Сколько хлорида калия содержится в 1 л раствора?
15. Для осаждения всего хлора, содержащегося в 15 мл раствора хлорида натрия, израсходовано 25 мл 0,1 М раствора нитрата серебра. Сколько граммов хлорида натрия содержит 1 л этого раствора?
16. Некоторое количество гидроксида калия растворено в воде и разбавлено до 200 мл. Для нейтрализации 50 мл этого раствора потребовалось 10,7 мл 1 н. раствора серной кислоты (fэкв =  ). Сколько гидроксида калия растворили в воде?
). Сколько гидроксида калия растворили в воде?
17. На нейтрализацию 20 мл 0,15 М раствора NaOH израсходовано 30 мл раствора уксусной кислоты. Сколько граммов уксусной кислоты содержит 1 л этого раствора?
18. На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, было израсходовано 24 мл 0,25 н. раствора серной кислоты (fэкв =  ). Рассчитайте молярную массу эквивалента щелочи.
). Рассчитайте молярную массу эквивалента щелочи.
19. Для осаждения в виде хлорида серебра всего серебра, содержащегося в 100 мл раствора нитрата серебра, потребовалось 50 мл 0,2 М раствора хлороводородной кислоты. Чему равна молярная концентрация эквивалента раствора нитрата серебра?
20. Сколько граммов гидроксида натрия содержится в 1 л раствора, если на нейтрализацию 16 мл этого раствора израсходовано 20 мл 0,25 М раствора HCl?
21. На нейтрализацию 50 мл раствора, содержащего 0,981 г кислоты, израсходовано 40 мл 0,5 М раствора NaOH. Определить молярную массу эквивалента кислоты.
22. На титрование 20 мл раствора азотной кислоты затрачено 15 мл 0,12 М раствора гидроксида натрия. Вычислите молярную концентрацию эквивалента, титр и массу азотной кислоты в 250 мл раствора.
23. Сколько воды надо прибавить к 200 мл 1М раствора гидроксида натрия, чтобы получить 0,05 М раствор?
24. Для нейтрализации 20 мл 0,1 н. раствора серной кислоты (fэкв =  ) потребовалось 8 мл раствора гидроксида натрия. Сколько граммов гидроксида натрия содержит 1 л такого раствора?
) потребовалось 8 мл раствора гидроксида натрия. Сколько граммов гидроксида натрия содержит 1 л такого раствора?
25. Какое вещество и в каком количестве (в граммах) останется в избытке, если к 75 мл 0,3 н. раствора серной кислоты (fэкв =  ) прибавить 125 мл 0,2 н. раствора гидроксида калия?
) прибавить 125 мл 0,2 н. раствора гидроксида калия?
26. На нейтрализацию 1 л раствора, содержащего 1,4 г гидроксида калия, требуется 50 мл раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты.
27. Какой объем 0,3 н. раствора серной кислоты (fэкв =  ) требуется для нейтрализации раствора, содержащего 0,32 г гидроксида натрия в 40 мл?
) требуется для нейтрализации раствора, содержащего 0,32 г гидроксида натрия в 40 мл?






