Бронхиальная астма — весьма распространенное заболевание; им страдают 3-5 % населения. Характерная особенность заболевания - гиперреактивность дыхательных путей (бронхов) в ответ на различные стимулы. Клинически бронхиальная астма проявляется эпизодическими приступами одышки, кашля и свистящего дыхания. Обструкция дыхательных путей, которая носит обратимый характер, обусловлена сокращением гладкой мус-
кулатуры бронхов, отеком слизистой оболочки и повышенной секрецией слизи. В соответствии с классической моделью, обструкцию бронхов провоцируют присутствующие в воздухе разнообразные вещества, в том числе пыльца, шерсть животных, пыль, грязь и многочисленные химические соединения. Иногда бронхоспазм развивается при приеме внутрь аспирина, нестероидных противовоспалительных средств, сульфитов или тарт-разина и других пищевых красителей. У некоторых пациентов бронхоспазм провоцируется физической нагрузкой, эмоциональными переживаниями и вирусными инфекциями.
Термин экзогенная (аллергическая) астма применяется в тех случаях, когда приступы заболевания связаны с воздействием внешних факторов; термин эндогенная (идиосинкразическая) астма означает, что при данной форме заболевания приступы возникают без внешней провокации. Хотя при аллергической астме в большинстве случаев отмечаются положительные реакции на различные антигены и повышенный уровень IgE, эта классификация несовершенна; у многих пациентов присутствуют симптомы обеих форм. Более того, иногда хронический бронхит протекает с бронхоспазмом.
Патофизиология. В патогенезе астмы играет роль местное высвобождение в дыхательных путях различных химических медиаторов и, возможно, повышенная активность парасимпатической нервной системы. Вдыхаемые вещества провоцируют бронхоспазм через специфические или неспецифические иммунные механизмы, вызывая дегрануляцию тучных клеток в бронхах. По классической модели астмы, антиген связывается с IgE на поверхности тучных клеток, что вызывает pix дегрануляцию; бронхоконстрикция является результатом последующего высвобождения гиста-мина; брадикинина; лейкотриенов С, D и E; фактора активации тромбоцитов; простагландинов PGE2, PGF2Q и PGD2, а также факторов хемотаксиса нейтрофилов и эозинофилов. Роль серотони-на, при некоторых состояниях проявляющего себя мощным бронхоконстриктором, в генезе бронхо-спазма у человека не ясна. Парасимпатическая нервная система играет большую роль в поддержании нормального тонуса бронхов (гл. 22); выявлены суточные ритмы бронхиального тонуса: например, обнаружено, что сопротивление дыхательных путей максимально в 6 ч утра. Афферентные окончания блуждающего нерва в бронхах чувствительны к гистамину и множеству ноци-цептивных стимулов, включая холодный воздух, раздражающие вещества и манипуляции в дыха-
тельных путях (например, интубация трахеи). Рефлекторная активация блуждающего нерва приводит к бронхоконстрикции, опосредованной увеличением содержания циклического гуанозин-монофосфата (цГМФ) в клетках.
Во время приступа астмы бронхоконстрикция, отек слизистой и секреция слизи увеличивают сопротивление потоку воздуха на всех уровнях нижних дыхательных путей. Когда приступ разрешается, сопротивление нормализуется в первую очередь в крупных бронхах (главные, долевые, сег-ментарные и субсегментарные) и только потом в мелких. Следовательно, если на высоте приступа скорость экспираторного потока уменьшена на уровне жизненной емкости легких, то в процессе разрешения приступа скорость потока снижена только на уровне малых легочных объемов. Возрастают общая емкость легких, остаточный объем и ФОБ. Во время тяжелого приступа остаточный объем может увеличиваться более чем на 400 %, ФОБ — более чем на 100 %. Если приступ очень тяжелый или длительный, то значительно повышается работа дыхания и возникает усталость дыхательных мышц. Количество альвеолярных единиц с низким вентиляционно-перфузионным отношением возрастает, приводя к гипоксемии. Вследствие стимуляции бронхиальных рецепторов развивается тахипноэ, что приводит к гипокапнии (гл. 22). Нормальное или высокое PaCO2 часто является предвестником угрожающей дыхательной недостаточности. Парадоксальный пульс (гл. 21) и ЭКГ-симптомы перегрузки правого желудочка (изменения сегмента ST, отклонение электрической оси сердца вправо, блокада правой ножки пучка Тиса) тоже свидетельствуют о значительной обструкции дыхательных путей.
Лечение. К препаратам для лечения бронхиальной астмы относятся (3-адреномиметики, ме-тилксантины, кортикостероиды, холиноблокато-ры и стабилизаторы мембран тучных клеток. Все они, кроме стабилизаторов мембран тучных клеток, могут применяться как для профилактического лечения бронхиальной астмы, так и для устранения приступа. Кромолин натрия и недо-кромил эффективны только для предотвращения бронхоспазма у большинства пациентов с экзогенной формой астмы и у некоторых с эндогенной. Оба средства лишены бронходилатирующе-го действия, ohpi блокируют дегрануляцию тучных клеток.
Симпатомиметики (табл. 23-2) — наиболее эффективные и широко используемые при бронхиальной астме препараты. Они вызывают брон-ходилатацию, стимулируя (32-адренорецепторы.
Стимуляция (32-адренорецепторов гладких мышц бронхов активизирует аденилатциклазу, что увеличивает образование циклического аденозин-монофосфата (цАМФ) в клетке. Эти препараты употребляют в форме дозированного аэрозоля с помощью ингаляторов, а также в форме раствора для ингаляций через небулизаторы (гл.4). Применение селективных (32-адреномиметиков (например, тербуталина или альбутерола), снижает частоту нежелательных побочных эффектов, обусловленных влиянием на |3гадренорецепторы сердца.
Ранее считалось, что метилксантины вызывают бронходилатацию, ингибируя фосфодиэстеразу — фермент, обеспечивающий гидролиз цАМФ. Оказалось, что действие метилксантинов на легкие имеет более сложный характер и включает стимуляцию высвобождения катехоламинов, блокаду высвобождения гистамина и стимуляцию диафрагмы. Препараты теофиллина длительного действия назначают внутрь при ночных приступах бронхиальной астмы. К сожалению, теофиллин обладает узкой терапевтической широтой: терапевтическая концентрация в крови варьируется от 10 до 20 мкг/мл. Вместе с тем он может быть эффективен и в более низких концентрациях. Единственным препаратом теофиллина для внутривенного введения является аминофиллин.
Благодаря противовоспалительному и мембра-ностабилизирующему действию кортикостероиды назначают как для поддерживающей терапии, так и для лечения острых приступов. Беклометазон, триамцинолон, флунизолид и будезонид — это синтетические стероиды, часто применяющиеся в форме дозированного аэрозоля для поддерживающей терапии. Хотя при ингаляции кортикостеро-
ТАБЛИЦА 23-2. Сравнительная характеристика наиболее распространенных бронходилататоров
| Препарат Адренергическая активность | ||
| Pi | P2 | |
| Альбутерол (вентолин) | + | ++++ |
| Битольтерол (торналат) | + | ++++ |
| Адреналин | ++++ | ++ |
| Изоэтарин (бронкозол) | ++ | +++ |
| Изопротеренол (изупрел) | ++++ | ++ |
| Метапротеренол (алупент) | + | + |
| Пирбутерол (максаир) | + | ++++ |
| Сальметарол (серевент) | + | ++++ |
| Тербуталин (бретаир) | -ь | +++ |
+ — степень активности.
идов риск нежелательных системных эффектов низок, тем не менее существует некоторая вероятность возникновения надпочечниковой недостаточности. При тяжелых приступах астмы используют гидрокортизон или метилпреднизолон в/в, после чего назначают преднизолон внутрь, постепенно снижая дозу. Для наступления эффекта кор-тикостеридов требуется несколько часов.
Холиноблокаторы вызывают бронходилата-цию, блокируя м-холинорецепторы, а также устраняя рефлекторную бронхоконстрикцию, опосредованную блуждающим нервом. Ипратропиум, химически близкий к атропину препарат, назначают ингаляционно в форме дозированного аэрозоля или распыляют через небулизатор; он является бронходилататором средней мощности и не имеет выраженных системных антихолинергических эффектов.
Анестезия
Предоперационный период. При бронхиальной астме важно установить, как протекает заболевание и насколько оптимально состояние больного к моменту операции. Разница между проведением анестезии у пациента с громким свистящим дыханием и у пациента без такового — это разница между опасным для жизни анестезиологическим экспериментом и спокойной анестезией без осложнений. Ключевое значение имеет анамнез заболевания. Оптимально, если одышки, свистящего дыхания и кашля нет совсем или они выражены незначительно. Отсутствие обострения бронхиальной астмы необходимо подтвердить с помощью аускультации грудной клетки. При рецидивирующем или хроническом бронхоспазме нужно подобрать схему лечения на основе |32-адреномимети-ков, теофиллина и, возможно, кортикостероидов. Для верификации клинических данных проводят исследование функции легких, особенное внимание уделяя 0OB1 и пиковой объемной скорости потока на выдохе (ПОС). Чрезвычайно важна динамика этих показателей. В норме 0OB1 должен составлять > 3 л у мужчин и > 2 л у женщин. ПОС должна превышать 200 л/мин (у молодых мужчин ПОС часто составляет > 500 л/мин). Если QOB1 или ПОС < 50 % нормы, это указывает на средне-тяжелое или тяжелое течение бронхиальной астмы. Рентгенография грудной клетки полезна для оценки степени выраженности "воздушной ловушки": перераздувание легких приводит к уплощению диафрагмы, сужению тени сердца и повышению воздушности легочных полей.
Если пациент с бронхиальной астмой и остро протекающим бронхоспазмом нуждается в экст-
ренном хирургическом вмешательстве, ему показана интенсивная терапия. Оксшенотерапия, ами-нофиллин и кортико стероиды в/в, ингаляция 132~адреномиметиков через небулизаторы — эти мероприятия могут за несколько часов решительным образом улучшить функцию легких. В тяжелых случаях показано исследование газов артериальной крови. Гипоксемия и гипокапния служат симптомами обструкции бронхов средней и тяжелой степени; гиперкапния, даже незначительная, указывает на существенный объем "воздушной ловушки" и может быть предвестником угрожающей дыхательной недостаточности. 0OB1 < 25 % от нормы также относится к прогностическим признакам возникновения дыхательной недостаточности.
Перед плановой операцией у пациентов с бронхиальной астмой желательна легкая седация, особенно если заболевание имеет эмощюнальный компонент. Как правило, наиболее подходящими препаратами для премедикации являются бензо-диазепины. Холиноблокаторы обычно не применяют, за исключением тех случаев, когда у больного много мокроты или когда для индукции анестезии используют кетамин. Стандартные дозы холиноб-локаторов при в/м введении не предотвращают бронхоспазм, обусловленный интубацией. Считается, что блокаторы Н2-рецепторов (циметидин или ранитидин) применять нежелательно: активация Н2-рецепторов в норме вызывает бронходила-тацию, и в случае высвобождения гистамина неуравновешенная активация H1-рецепторов в сочетании с блокадой Н2-рецепторов может спровоцировать бронхоконстрикцию.
Бронходилататоры не отменяют вплоть до начала операции. Измерение концентрации теофиллина в крови в предоперационном периоде преследует три цели: обеспечение оптимальной бронходилатации, обнаружение скрытой передозировки и коррекция лечения (если во время операции показано введение аминофиллина). При длительном лечении кортикостероидами во избежание возникновения надпочечниковой недостаточности следует назначить дополнительные дозы этих препаратов. Чаще всего применяют гидрокортизон в/м или в/в — 100 мг перед операцией и 100 мг во время операции.
Интраоперационный период. Манипуляции на дыхательных путях — наиболее критический момент при общей анестезии у пациента с бронхиальной астмой. Масочная анестезия и регионарная блокада позволяют обойти эту проблему, но также не исключают риска развития бронхоспазма. Некоторые клиницисты считают, что высокая спин-
номозговая или эпидуральная анестезия способна усугублять бронхоконстрикцию, потому что блокада симпатической иннервации нижних дыхательных путей (T1-T4) влечет за собой несбалансированное усиление парасимпатической активности. Бронхоспазм потенцируют такие стимулы, как боль, эмоциональный стресс и хирургическая стимуляция при поверхностной общей анестезии. Нужно избегать препаратов, вызывающих высвобождение гистамина (тубокурарин, атракурий, ми-вакурий, морфин, меперидин); в случае необходимости их вводят очень медленно. Общая анестезия должна отвечать следующим требованиям: гладкая индукция и пробуждение, возможность управления глубиной анестезии в соответствии с уровнем хирургической стимуляции.
Выбор препарата для индукции не столь важен, как достижение достаточной глубины анестезии перед интубацией и хирургической стимуляцией. У взрослых чаще всего применяют тиопентал, хотя он изредка вызывает бронхоспазм из-за высвобождения гистамина. Альтернатива — пропофол и это-мидат; многие врачи предпочитают использовать именно эти средства у подобных больных. Кета-мин — единственный внутривенный анестетик, обладающий бронходилатирующими свойствами,— является препаратом выбора при нестабильной ге-модинамике у пациентов с бронхиальной астмой. Кетамин нельзя применять при высокой концентрации теофиллина в крови, так как сочетание этих препаратов чревато ppickom возникновения судорог. Галотан обеспечивает гладкую индукцию анестезии с бронходилатацией у детей, страдающих бронхиальной астмой. Энфлюран, изофлюран идесфлю-ран также вызывают бронходилатацию, но концентрацию двух последних препаратов повышают крайне медленно, так как они оказывают незначительное раздражающее действие на дыхательные пути.
При бронхиальной астме интубация трахеи сопряжена с риском развития рефлекторного брон-хоспазма. Предотвращают это осложнение несколькими способами: вводят дополнительную дозу тиопентала (1-2 мг/кг); в течение 5 мин вентилируют больного через маску дыхательной смесью с 2-3 МАК ингаляционного анестетика; вводят лидокаин в/в или в трахею (1-2 мг/кг). Отметим, что введение лидокаина в трахею само по себе может спровоцировать бронхоспазм, если доза тиопентала была недостаточна. Холиноблокаторы в высоких дозах (2 мг атропина или 1 мг гликопирролата) тоже блокируют рефлекторный бронхоспазм, но при этом вызывают чрезмерную тахикардию. Сукцинилхолин может вызвать выраженное высвобождение гистамина, но в большинстве случаев при
бронхиальной астме его применение безопасно. При выраженном бронхоспазме и в отсутствие капногра-фа подтверждение правильности положения эндот-рахеальной трубки аускультацией грудной клетки может быть затруднено.
Для поддержания анестезии чаще всего используют ингаляционные анестетики, потому что они обладают мощным бронходилатирующим эффектом. Галотан сенсибилизирует сердце к аритмоген-ным эффектам аминофиллина и (3-адреномимети-ков (которые часто назначают во время операции у пациентов с бронхиальной астмой), а также обладает гепатотоксичностью, поэтому у взрослых пациентов этот анестетик применять не следует. Дыхательную смесь необходимо подогревать и увлажнять. Экспираторную обструкцию дыхательных путей можно выявить с помощью капнографии: она проявляется замедлением подъема восходящего колена кривой концентрации CO2 (рис. 23-1), причем степень обструкции обратно пропорциональна скорости подъема концентрации CO2 на выдохе. Тяжелый бронхоспазм характеризуется увеличением пикового давления вдоха и неполным выдохом. Рекомендуемые параметры ИВЛ: дыхательный объем 10-12 мл/кг, частота дыхания 8-1 О/мин. Относительно низкая частота дыхания обеспечивает сравнительно большую продолжительность вдоха и выдоха, что приводит к более равномерному распределению газового потока в легких и позволяет предупредить возникновение "воздушной ловушки". Некоторые исследователи предполагают, что увеличение продолжительности выдоха за счет относительно высокого инспира-торного потока газа и укорочения продолжительности вдоха позволяет улучшить газообмен.
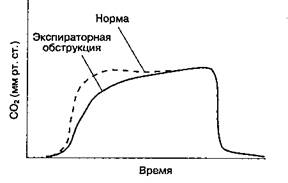
|
| Рис. 23-1.Капнография при экспираторной обструкции дыхательных путей |
Интраоперационный бронхоспазм проявляется свистящим дыханием, повышением пикового давления вдоха (вследствие уменьшения растяжимости), уменьшением экспираторного дыхательного
объема, замедлением подъема восходящего колена кривой концентрации CO2 на капнограмме. Брон-хоспазм устраняют увеличением концентрации ингаляционного анестетика (т. е. углублением анестезии). Если после этого свистящее дыхание не исчезает, то перед использованием бронходила-таторов необходимо исключить состояния, имитирующие бронхоспазм: обструкцию эндотрахеалъ-ной трубки вследствие перегибания, закупорки мокротой или перераздувания манжетки; интубацию бронха; попытки самостоятельного дыхания при поверхностной анестезии; отек легких или эмболию легочной артерии; пневмоторакс. Легкий и среднетяжелый бронхоспазм устраняют (3-адре-номршетиками, которые распыляют с помощью не-булизатора непосредственно в инспираторное колено дыхательного контура. Можно использовать и ингаляторы с дозированными аэрозолями, однако они требуют специального переходника для подсоединения между эндотрахеальной трубкой и дыхательным контуром. Более того, при применении ингалятора для эффективной доставки препарата в нижние дыхательные пути может понадобиться 5-10 доз. Для лечения среднетяжелого и тяжелого бронхоспазма назначают аминофил-лин в/в, тербуталин (0,25 мг) п/к, а также их сочетание. Если больной не принимал теофиллин до операции, то вначале вводят нагрузочную дозу — 6 мг/кг аминофиллина в/в в течение 20 мин, а затем переходят на поддерживающую инфузию в дозе 0,5-0,9 мг/кг/ч. Если больной принимал теофиллин до операции, то нагрузочную дозу аминофиллина уменьшают в 2-4 раза, в зависимости от предоперационной концентрации теофил-лина в крови. Применяют также гидрокортизон (1,5-2 мг/кг в/в), особенно если пациент раньше принимал кортикостероиды.
В идеале после операции у больного не должно быть свистящего дыхания. Устранение действия недеполяризующих миорелаксантов при помощи
ингибиторов ацетилхолинэстеразы не провоцирует бронхоконстрикцию, если сочетается с предварительным введением холиноблокатора (гл. 10). Экстубация, выполненная до восстановления рефлексов дыхательных путей, предотвращает бронхоспазм при пробуждении. Введение лидокаина (в/в струйно в дозе 1,5-2 мг/кг или в виде продолжительной инфузии в дозе 1-2 мг/мин) позволяет подавить рефлексы дыхательных путей при пробуждении.






