В норме электрические импульсы в сердце вырабатываются синусовым узлом — группой специализированных клеток, расположенных в стенке правого предсердия впереди от отверстия верхней полой вены. Мембрана этих клеток характеризуется повышенной проницаемостью для натрия и,
ТАБЛИЦА 19-1. Потенциал действия кардиомиоцита
| Фаза | Название | Событие | Движение ионов |
| О | Деполяризация | Активация (открытие) быстрых Na^-каналов и снижение проницаемости мембраны для Ю | Na^ поступает в клетку |
| Начальная быстрая реполяризация | Инактивация Na'-каналов и преходящее увеличение проницаемости мембраны для К4 | К* выходит из клетки | |
| Плато | Активация медленных Са2+-каналов | Ca2+ поступает в клетку | |
| Конечная быстрая реполяризация | Инактивация Са2+-каналов и увеличение проницаемости мембраны для K+ | K+ выходит из клетки | |
| Потенциал покоя или | Восстановление исходной проницаемости мембраны кардиомиоцитов предсердий и желудочков | К* выходит из клетки | |
| Диастолическая деполяризация | Медленный ток Na+ и, возможно, Ca2+ внутрь клеток, приводящий к спонтанной деполяризации | Na+ поступает в клетку? Ca2+ поступает в клетку |
возможно, кальция. Медленный ток натрия приводит к снижению потенциала покоя клеток синусового узла (-50— -60 мВ против -80— -90 мВ в кардиомиоцитах желудочков) и имеет три важных следствия: постоянную инактивацию быстрых натриевых каналов; потенциал действия
с порогом -40 мВ, обусловленный в первую очередь движением ионов через медленные кальциевые каналы; регулярную спонтанную деполяризацию. В диастолу поступление натрия в клетку приводит к тому, что мембрана клетки постепенно становится все менее отрицательной; когда дости-
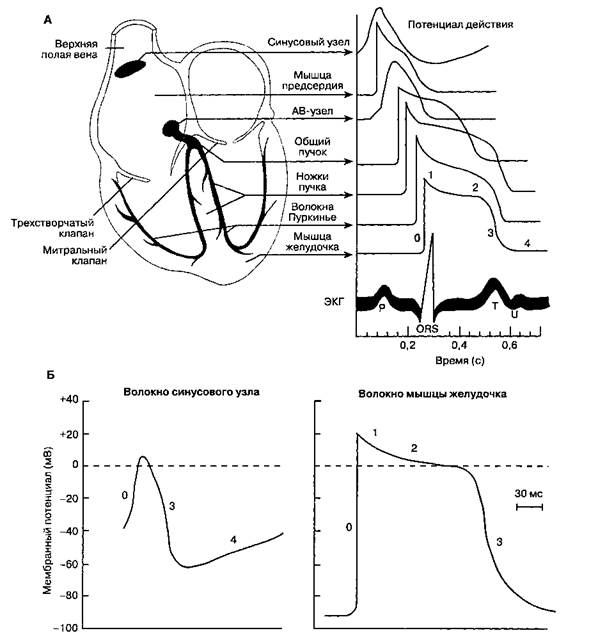
Рис. 19-1. Потенциалы действия сердца. А. Характеристика потенциалов действия различных отделов сердца. Б. Клетки пейсмекера синусового узла характеризуются отчетливой спонтанной диастолической деполяризацией, в них значительно слабее выражены четкие фазы потенциала действия, в отличие от клеток миокарда предсердия или желудочка. Смотрите табл. 19-1 для объяснения различных фаз потенциала действия. (С изменениями. Из: Ganong W. F. Review of Medical Physiology, 16th ed. Appleton & Lange, 1993.)
гается пороговый потенциал, то открываются кальциевые каналы, уменьшается проницаемость мембраны для калия и развивается потенциал действия. Восстановление нормальной проницаемости для калия возвращает клетки синусового узла в состояние покоя.
Импульс, возникший в синусовом узле, в нормальных условиях быстро распространяется по предсердиям pi к АВ-узлу. Специализированные волокна проводят возбуждение как к левому предсердию, так и к АВ-узлу. АВ-узел расположен с правой стороны межпредсердной перегородки, впереди от отверстия венечного синуса и над перегородочной створкой трехстворчатого клапана. В АВ-узле выделяют три отдельные области: верхнюю, среднюю и нижнюю. Средняя область АВ-уз-ла не обладает внутренней спонтанной активностью (автоматизмом), в то время как верхняя и нижняя области способны вырабатывать импульсы. В физиологических условиях водителем ритма является синусовый узел, потому что частота его спонтанной диастолической деполяризации выше, чем в верхней и нижней областях АВ-узла, где она составляет 40-60 мин"1. Любой фактор, уменьшающий частоту деполяризации синусового узла или увеличивающий автоматизм верхней и нижней областей АВ-узла, способствует возникновению АВ-узлового ритма.
Импульсы из синусового узла в норме достигают АВ-узла через 0,04 с и покидают его через последующие 0,11 с. Эта задержка связана с низкой скоростью проведения возбуждения в тонких волокнах внутри АВ-узла, что в свою очередь определяется активацией медленных кальциевых каналов. Напротив, проведение импульса между примыкающими друг к другу клетками в предсердиях и желудочках определяется активацией и инактивацией быстрых натриевых каналов. Волокна, отходящие от нижней части АВ-узла, образуют пучок Гиса. Эта специализированная группа волокон проходит в межжелудочковую перегородку, а затем разделяется на левую и правую ножки, разветвляющиеся в сложную сеть волокон Пуркинье, которые деполяризуют оба желудочка. Волокна Гиса-Пуркинье разительно отличаются от ткани АВ-узла: они имеют наиболее высокую скорость проведения в сердце, что приводит к почти одновременной деполяризации эндокарда обоих желудочков (в норме это занимает 0,03 с). Распространение возбуждения от эндокарда к эпикарду через миокард требует еще 0,03 с. Таким образом, импульсу, возникающему в синусовом узле, в нормальных условиях необходимо менее 0,2 с для деполяризации всего сердца.
Галотан, энфлюран и изофлюран угнетают автоматизм синусового узла. С другой стороны, данные препараты оказывают лишь весьма умеренное непосредственное влияние на АВ-узел, увеличивая время проведения возбуждения и рефрактерность. Сочетание этих эффектов позволяет объяснить высокий риск возникновения AB-узловой тахикардии в тех случаях, когда на фоне ингаляционной анестезии для лечения синусовой брадикардии применяют холиноблокаторы: скорость водителей ритма в АВ-узле возрастает в большей степени, чем таковая в синусовом узле. Электрофизиологические эффекты ингаляционных анестетиков на волокна Пуркинье и миокард желудочков имеют сложный характер из-за участия в процессе вегетативной нервной системы. Описаны как антиаритмические, так и аритмогенные свойства анестетиков. Первые могут быть обусловлены прямым подавлением потока Ca2+ внутрь клетки, вторые — потенцированием действия катехоламинов (гл. 7). Для возникновения аритмогенного эффекта необходима активация как Q1-, так и (3-адренорецепторов.
Токсическая концентрация местных анестетиков в крови сопряжена с риском развития электрофизиологических нарушений в сердце. Лидокаин способен оказывать антиаритмическое действие при низкой концентрации в крови (гл. 48). При высокой концентрации в крови местные анестети-ku подавляют проведение возбуждения в сердце, связываясь с быстрыми натриевыми каналами. Самые мощные местные анестетики — бупивакаин и, в меньшей степени, этидокаин и ропивакаин, по-видимому, оказывают наиболее сильное влияние на сердце, особенно на волокна Пуркинье и миокард желудочков. Бупивакаин связывается с инак-тивированными быстрыми натриевыми каналами (и затем медленно диссоциирует), что приводит к возникновению тяжелой синусовой брадикардии, остановки синусового узла, а также опасной для жизни желудочковой аритмии.
Антагонисты кальция представляют собой органические химические соединения, которые блокируют ток кальция внутрь клетки через медленные каналы. Антагонисты кальция из группы дигидро-пиридинов (нифедипин) перекрывают канал, а вера-памил и, в меньшей степени, дилтиазем связываются с деполяризованным инактивированным каналом.
Механизм сокращения
Клетки миокарда сокращаются в результате взаимодействия двух сократительных белков — актина и миозина. Эти белки фиксированы внутри клетки как во время сокращения, так и при рас-
слаблении. Сокращение клетки происходит, когда актин и миозин взаимодействуют и скользят друг относительно друга (рис. 19-2). Это взаимодействие в норме предотвращается двумя регулирующими белками: тропонином и тропомиозином. Молекулы тропонина присоединены к молекулам актина на одинаковом расстоянии друг от друга. Тропомиозин располагается в центре актиновых структур. Увеличение концентрации внутриклеточного кальция (приблизительно с 10~7 до 10~5 моль/л) приводит к сокращению, поскольку ионы кальция связывают тропонин. Кальций изменяет конформацию тропонина, что обеспечивает открытие активных участков у молекул актина, способных взаимодействовать с миозиновыми мостиками. Активные участки на миозине функционируют как Mg-зависимая АТФ-аза, чья активность возрастает при увеличении концентрации кальция внутри клетки. Мостик миозина последовательно соединяется и разъединяется с новым активным участком актина. При каждом соединении потребляет ся АТФ.






