Инженерно-технический институт
Кафедра металлургии, машиностроения и
Технологического оборудования
Расчет термодинамических параметров
Раскисления стали
Учебно-методическое пособие
к выполнению курсовой работы по курсу
«Теория и технология производства стали»
Направление: 150400.62 – металлургия
Специальность: 150101.65 – металлургия черных металлов
ЧЕРЕПОВЕЦ
УДК
Расчет термодинамических параметров раскисления стали: Учеб.-метод. пособие к выполнению курсовой работы по курсу «Теория и технология производства стали». Череповец: ЧГУ, 2011. с.
Рассмотрено на заседании кафедры металлургии, машиностроения и технологического оборудования 29 сентября 2011 г., протокол № 1. Одобрено редакционно-издательской комиссией Инженерно-технического института сентября, протокол №.
Рецензенты: А.Т. Степанов – к.т.н., доцент (ГОУ ВПО ЧГУ)
Г.С. Козлов – к.т.н., доцент (ГОУ ВПО ЧГУ)
Научный редактор: А.Т. Степанов – к.т.н., доцент (ГОУ ВПО ЧГУ)
Составители: С.Н. Сумин – к.т.н., доцент (ГОУ ВПО ЧГУ)
З.К. Кабаков – д.т.н., профессор (ГОУ ВПО ЧГУ)
 Ó Череповецкий государственный университет, 2011
Ó Череповецкий государственный университет, 2011
Введение
Цель курсовой работы – приобрести практические навыки использования теории раскисления металла для термодинамических расчетов сталеплавильных процессов.
Работа включает разделы, название которых соответствуют названию данного пособия.
В задании на курсовую работу указывается последовательность выполнения расчетов. Необходимые для расчетов стандартные свободные энергии образования оксидов при температурах сталеплавильных процессов, термодинамические данные реакций растворения элементов в жидком железе, численные значения термодинамических массовых параметров взаимодействия первого порядка элементов в железе при 1600°С приведены в Приложении 1. Справочные таблицы 1, 2, 3, 4. Варианты заданий на курсовую работу приведены в Приложении 2.
Задание на курсовую работу
1.1. Выбрать согласно варианту задания состав стали и раскислитель.
1.2. Составить схему реакции и перехода от одного стандартного состояния к другому и, используя табличные значения энтальпий DН° и энтропии S° исходных компонентов, получить температурную функцию константы равновесия реакции раскисления.
1.3. Для заданного интервала температур построить график температурной функции константы равновесия реакции раскисления в координатах  .
.
1.4. По табличным данным и с учетом температурных функций термодинамических массовых параметров взаимодействия первого порядка элементов в железе рассчитать равновесное содержание кислорода в металле в зависимости от концентрации элемента-раскислителя и активности продуктов раскисления, которая принимается равной 0,1; 0,5; 1,0.
1.5. По результатам расчетов построить кривые раскисления – графические зависимости:
- равновесное содержание кислорода в металле от концентрации элемента-раскислителя и активности продукта расиксления при данной температуре;
- равновесное содержание кислорода в металле от температуры и активности продукта раскисления при заданной концентрации элемента-ракислителя.
1.6. Сравнить расчетные значения константы равновесия реакции раскисления с литературными данными.
1.7. Сделать выводы о влиянии температуры, активности продуктов раскисления, состава стали на раскислительную способность элемента.
Раскисление стали
В условиях окислительной плавки повышается содержание кислорода в металле на выпуске. Поэтому перед разливкой проводится раскисление металла. Это заключительная технологическая операция, которая определяет качество готового металла.
Основными задачами раскисления являются:
1. снижение концентрации кислорода, растворенного в металле, присадками элементов-раскислителей до необходимого уровня, обеспечивающего повышение качества металла;
2. создание условий для более полного удаления образующихся продуктов раскисления из расплава металла.
По степени раскисления стали делятся на кипящие, спокойные и полуспокойные.
Кипящая сталь при заливке в изложницу или кристаллищатор УНРС содержит достаточно много кислорода (0,02-0,06 %) [1]. Содержание кислорода в стали определяется концентрацией углерода, а также отсутствием кремния и алюминия.
Состав кипящей стали: [% C] = 0,05 … 0,21; [% Mn] = 0,3 … 0,5.
В процессе кристаллизации металла жидкая фаза непрерывно обогащается углеродом, кислородом и другими примесями за счет ликвации. При этом фактическое произведение концентраций углерода и кислорода ([%C] [%O])ф становится выше равновесного ([%C] [%O])р, что приводит к выделению монооксида углерода по реакции
[C] + [O] ={CO}
или кипению металла.
Спокойная сталь содержит мало кислорода (< 0,005 %), что значительно ниже равновесных с углеродом значений, поэтому пузыри моноксида углерода в металле не образуются [1].
Химический состав стали: [%C] – изменяется в широких пределах; [% Mn] = 0,5 … 0,8; [% Si] = 0,15 … 0,35; [% Al] = 0,02 … 0,10.
Легированные стали содержат дополнительные элементы Cr, Ni, Mo, Ti, V, Zr и др. или повышенные количества Si, Mn и Al.
Полуспокойная сталь по содержанию кислорода занимает промежуточное положение между кипящей и спокойной. Обычно полуспокойная сталь содержит: [% Mn] = 0,4 … 0,5; [% Si] = 0,08 … 0,12 [1].
В процессе кристаллизации стали в результате ликвации углерода и кислорода образуются пузыри монооксида углерода, которые располагаются в верхней части слитка.
Полуспокойная сталь по структуре более однородна, чем кипящая сталь, но несколько хуже по качеству, чем спокойная сталь.
Для раскисления стали применяют два основных способа – осаждающее или глубинное и диффузионное или экстракционное.
При осаждающем раскислении элементы-раскислители вводятся в металл, где образуются оксидные неметаллические включения (НВ). Необходимо создать условия для лучшей коагуляции и ассимиляции НВ шлаком.
При диффузионном раскислении элементы-раскислители вводятся в шлак, снижающие концентрацию оксидов железа. В результате фактическое содержание кислорода в металле [% O]ф будет больше равновесного со шлаком  .
.
По закону распределения содержание кислорода в металле снижается за счет диффузии кислорода в шлак до установления равновесия
 ,
,
где L О – коэффициент распределения кислорода между фазами.
Диффузионное раскисление обычно проводят в дуговых электропечах, где можно создать восстановительную газовую атмосферу и лучше раскислить шлак. Однако диффузионное раскисление протекает медленно и требует повышенного расхода материалов, осаждающее раскисление более простой и дешевый способ обработки, поэтому применяется в массовых производствах стали, когда к чистоте металла по НВ не предъявляют особых требований.
Термодинамика процессов раскисления стали
Сущность процесса раскисления – перевод свободного кислорода, находящегося в растворе [O], в связанную форму в виде оксидных неметаллических включений.
При разработке технологии раскисления металла пользуются раскислительной способностью элементов [1].
Раскислительная способность элементов определяется содержанием кислорода, равновесным с определенной концентраций элемента – раксилителя при заданной температуре. Чем меньше равновесное содержание кислорода в металле при данной концентрации элемента, тем выше его раскислительная способность.
По раскислительной способности элементы располагаются в следующем порядке: Zr(10-5), Al(0,0002-0,002), Ti(0,002), B(0,007), Si(0,02), C(0,02), V(0,05), Cr(0,10), Mn(0,19). В скобках после символа элемента указано равновесное содержание кислорода в металле при концентрации раскислителя 0,1% по массе и температуре 1600°С.
В общем виде реакцию осаждающего раскисления можно представить в виде уравнения:
m[R] + n[O] = (RmOn),
где R – элемент-раскислитель.
Константа равновесия этой реакции
 . (1)
. (1)
Если активности элементов в металле заменить концентрациями в % по массе, то уравнение (1) запишем в другой форме:
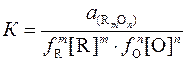 . (2)
. (2)
Из выражения константы равновесия (2) находим равновесное содержание кислорода в металле:
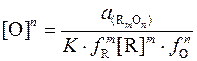 (3)
(3)
или
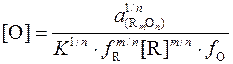 , (4)
, (4)
где  – активность продукта реакции раскисления; f O, f R – коэффициенты активности кислорода и элемента-раскислителя в металле.
– активность продукта реакции раскисления; f O, f R – коэффициенты активности кислорода и элемента-раскислителя в металле.
Из анализа уравнения (4) следует, что содержание растворенного в стали кислорода после раскисления зависит от нескольких факторов. Во-первых, растворимость кислорода зависит от величины константы равновесия реакции [2, 3].
Константа равновесия реакции и стандартная энергия Гиббса связаны известным соотношением:
 (5)
(5)
или
 . (6)
. (6)
Величина  определяет химическое сродство элемента к кислороду.
определяет химическое сродство элемента к кислороду.
Из выражения (6) видно, чем больше значение константы равновесия и соответственно выше химическое сродство элемента к кислороду ( ), тем при данной концентрации элемента-раскислителя меньше равновесное содержание кислорода в металле.
), тем при данной концентрации элемента-раскислителя меньше равновесное содержание кислорода в металле.
Все реакции раскисления являются экзотермическими, вследствие этого с понижением температуры их равновесие смещается вправо, а константа равновесия увеличивается. Это означает, что процесс раскисления металла протекает во время его охлаждения и последующей кристаллизации.
Во-вторых содержание кислорода в металле определяется активностью продуктов раскисления.
Если продукты раскисления металла образуются в чистом виде, тогда их активность  = 1. Это имеет место при раскислении стали достаточно большими количествами раскислителя. Если продукты раскисления образуют растворы с оксидами железа или другими оксидами, то значения их активностей
= 1. Это имеет место при раскислении стали достаточно большими количествами раскислителя. Если продукты раскисления образуют растворы с оксидами железа или другими оксидами, то значения их активностей  < 1, что позволяет при одном и том же содержании элемента-раскислителя в расплаве получить металл с более низкой равновесной остаточной концентрацией кислорода [2].
< 1, что позволяет при одном и том же содержании элемента-раскислителя в расплаве получить металл с более низкой равновесной остаточной концентрацией кислорода [2].
Равновесная концентрация кислорода в металле зависит также от коэффициентов активности кислорода и элемента-раксислителя.
С уменьшением значений коэффициентов активности f O и f R равновесная концентрация кислорода возрастает. Это может привести к тому, что концентрация кислорода, заметно снижаясь при небольших добавках элемента-раскислителя, будет повышаться при дальнейшем увеличении его концентрации.
Если в металле содержится несколько компонентов, то каждый из них оказывает влияние на коэффициент активности кислорода и другого компонента. Это влияние состава металла можно выразить через термодинамические массовые параметры взаимодействия первого порядка [2]:
 ; (6)
; (6)
 , (7)
, (7)
где  ,
,  - термодинамические массовые параметры взаимодействия элементов с кислородом и раскислителем;
- термодинамические массовые параметры взаимодействия элементов с кислородом и раскислителем;  ,
,  - частные коэффициенты активности, учитывающие влияние элементов на коэффициенты активности кислорода и раскислителя.
- частные коэффициенты активности, учитывающие влияние элементов на коэффициенты активности кислорода и раскислителя.
При низких концентрациях элементов в растворе значения термодинамических массовых параметров взаимодействия первого порядка можно принять постоянными величинами и выразить частные коэффициенты активности таким образом [4]:
 , (8)
, (8)
 . (9)
. (9)
Полные коэффициенты активности  и
и  равны произведению частных коэффициентов:
равны произведению частных коэффициентов:
 , (10)
, (10)
 . (11)
. (11)
Из соотношения (5) следует, что
 . (12)
. (12)
Используя уравнение Гиббса
 , (13)
, (13)
выражение (12) можно записать в другом виде:
 . (14)
. (14)
В общем случае
 , (15)
, (15)
где
 ;
;  .
.
После логарифмирования выражения (4) и ряда преобразований получим полное уравнение изотермы раскисления:
 (16)
(16)
Уравнение (16) является трансцендентным. Решение этого уравнения может быть найдено с использованием численных методов: метода половинного деления, метода Ньютона или касательных, метода хорд и др.






