Электрохимическая коррозия — самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов под влиянием внешних факторов, в котором, в отличие от химической коррозии, наблюдается направленное движение электронов от окисляемого металла к окислителю.
Электрохимическая коррозия возникает, когда соприкасаются два металла различной активности. Различие в энергиях ионизации и в величине сродства к электрону заставляет электроны переходить от более активного металла к менее активному, что и запускает процесс электрохимической коррозии.
Механизм электрохимической коррозии. Процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие процессы:
1) анодный процесс — переход ионов окисленного металла в раствор, сопровождающийся гидратацией (сольватацией):
Ме + n Н2O → Ме n +· nН2O + nē;
2) омический процесс — перетекание освободившихся электронов от анодных участков к катодным и движение ионов
в растворе;
3) катодный процесс — ассимиляция электронов каким-либо окислителем, при этом происходит катодное восстановление
окислителя Ох:
Ох + nē → Red.
Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы Н+, Fe3+, NO3– и др. Наиболее часто при коррозии в нейтральной и щелочной среде наблюдается восстановление кислорода:
О2 + 2Н2O + 4 ē → 4OН–,
а в кислой среде — выделение водорода:
2Н+ + 2 ē → Н2↑.
Коррозия с участием молекулярного кислорода называется коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические процессы, например взаимодействие образующихся ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций:
Me n + + n OH– = Ме(OН) n .
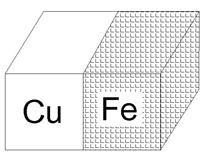
|
| Рис. 5. Атмосферная коррозия в результате контакта меди и железа |
Например, если железо находится в контакте с медью в атмосфере влажного воздуха (рис. 5), то менее активный металл медь выступает в роли катода, на котором происходит восстановление окислителя, а материал анода окисляется. Возникает гальванопара, при работе которой происходят процессы:
анод Fe0 – 2 ē → Fe2+;
катод О2 + 2Н2O +4 ē → 4OН–.
Далее происходят вторичные процессы:
Fe2+ +2OH– ←→ Fe(OH)2;
4Fe(OH)2 +O2 + H2O ←→ 4Fe(OH)3;
2Fe(OH)3 ←→ Fe2O3 + 3H2O.
Образующийся гидроксид железа (II) легко окисляется кислородом воздуха, что в конечном итоге приводит к образованию ржавчины m Fe2O3· n FeO· p H2O.
Образование гальванического элемента (гальванопары) из двух различных по активности металлов приводит к коррозии более сильной, чем для исходного активного металла. Например, цинк в растворе соляной кислоты (Е 0Zn2+/Zn0= – 0,762 B) реагирует с выделением водорода:
Zn + 2HCl = ZnCl2 +H2↑;
или в ионном виде:
Zn + 2H+ = Zn2++ H2↑;
но постепенно изолируется от раствора мелкими пузырьками образовавшегося газа, в результате чего его дальнейшее растворение прекращается.
Медь с разбавленной соляной кислотой не реагирует, так как находится в ряду напряжений после водорода, её стандартный электродный потенциал Е 0Cu2+/Cu0= +0,34 B. Но цинк в контакте с медью образует в разбавленной соляной кислоте коррозионную гальванопару:
(–) Zn│HCl│Cu (+).
В кислой среде наблюдается электрохимическая коррозия Zn с водородной деполяризацией, в которой роль анода играет более электроотрицательный (более активный) металл — цинк, так как
Е 0Zn2+/Zn0= – 0,762 B, в то время как Е 0Cu2+/Cu0= +0,34 B.
В процессе коррозии цинк растворяется:
анод: Zn – 2 ē → Zn2+ (окисление);
омический процесс — переход электронов с анода на катод:
 Zn 2 ē Cu;
Zn 2 ē Cu;
катод: 2H+ + 2 ē → H2 (на поверхности меди).
Продукт коррозии в кислой среде — хлорид цинка:
Zn2+ + 2Cl– = ZnCl2.
Очень часто электрохимическая коррозия возникает, когда металл содержит вкрапления металла меньшей активности или неметаллические, но, вместе с тем, токопроводящие включения (как, например, происходит в стали, где есть многочисленные включения карбида железа FeC3), становящиеся катодными участками электрохимической коррозии.
В качестве примера рассмотрим железо, которое в качестве примеси содержит включения меди (рис. 6). Вся конструкция погружена в разбавленный раствор соляной кислоты HCl. На поверхности меди происходит восстановление окислителя, а материал анода окисляется и растворяется:
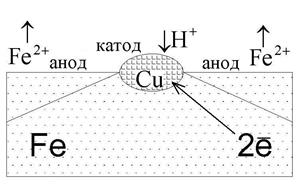
| HCl ←→ H+ + Cl–. Анод Fe0 – 2 ē → Fe2+; Fe2+ +2Cl– ←→ FeCl2. Катод H+ + ē → Н0; 2H0 ←→ H2↑. |
| Рис. 6. Коррозия железа с включениями меди |
Электрохимическая коррозия и ЭДС гальванопары. Возможность протекания коррозии может быть установлена по знаку ЭДС образующегося гальванического элемента. Если ЭДС > 0, то коррозия возможна. ЭДС равна разности потенциалов окислителя и восстановителя (катода и анода), поэтому коррозия возможна при условии, что потенциал катода (окислителя) положительнее потенциала анода (восстановителя). Если на аноде идет растворение металла, то должно быть Е Ох > Е Me n +/Me0.
Потенциал кислородного электрода при 298 К описывается уравнением:
Е 0O2/OH–= 1,23 –  pH +
pH + 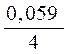 lg P O2.
lg P O2.
Потенциал водородного электрода описывается уравнением:
Е 02H+/H2= 0,00 –  pH +
pH + 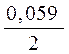 lg P H2.
lg P H2.
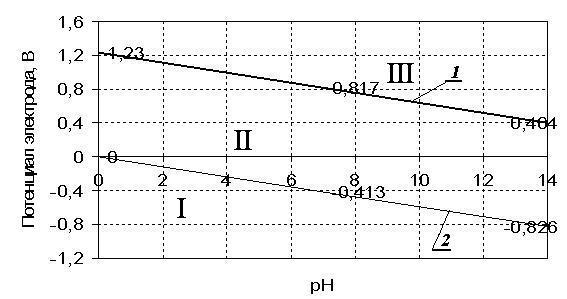
Графики зависимостей приведены на рис. 7, по ним можно определить возможность протекания коррозии различных металлов в водных средах.
Если потенциал металла положительнее потенциала кислородного электрода (который равен +1,2 В в кислой среде при pH = 1 и составляет около +0,8 В в нейтральной среде при pH = 7), то коррозия металла невозможна (область III).
|
| Рис. 7. Зависимость потенциала кислородного (линия 1) и водородного (линия 2) электродов от значения pH среды при P O2и P H2= 1 атм |
Если потенциал металла положительнее потенциала водородного электрода (последний равен нулю в кислых средах при pH = 1 и составляет около – 0,41 В в нейтральной среде при pH = 7) и отрицательнее потенциала кислородного электрода (область II), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода.
Если потенциал металла отрицательнее потенциала водородного электрода (область I), то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные, щелочноземельные, алюминий, цинк, и др.
Скорость электрохимической коррозии. Действие гальванических элементов в значительной мере зависит от поляризации и деполяризации. При этом может происходить как поляризация анода, которая выражается в том, что его потенциал становится более положительным, так и поляризация катода, вызываемая смещением его потенциала в отрицательную сторону.
Поляризация снижает скорость коррозии во много раз. Без поляризации многие металлы, в том числе и железо, корродировали бы с такой высокой скоростью, что потеряли бы свое техническое значение.
Скорость электрохимической коррозии можно определить по формуле:
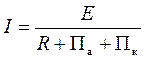 ,
,
где I — сила тока, величина которого указывает на скорость коррозии; R — омическое сопротивление раствора электролита; Па — поляризация анода, Пк — поляризация катода; Е — электродвижущая сила.
В зависимости от того, какая из величин (R, Па, Пк) оказывает ограничительное действие на скорость процесса, различают коррозию с различным контролем:
1) R >>(Па+Пк) — омический контроль;
2) Пк>>(R +Па) — катодный контроль;
3) Па>>(R +Пк) — анодный контроль.
Контролирующая стадия является лимитирующей для всего процесса, т.е. ограничивает скорость коррозии в целом, так как протекает медленнее других. Возможен и смешанный контроль, когда слагаемые в знаменателе приблизительно равны по величине.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание работы:
1. После ознакомления с теоретическим материалом выполнить опыты и записать наблюдения.
2. Во всех опытах записать происходящую окислительно-восстановительную реакцию и процессы окисления и восстановления. Во втором и третьем опытах составить схему образующихся гальванических элементов (гальванопар).






