Связь между количеством выделившегося при электролизе веществ и количеством электричества, прошедшего через электролит, выражается двумя законами Фарадея.
Первый закон Фарадея. Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит:
m = kQ,
где m — масса вещества, г; k – электрохимический эквивалент, т.е. масса вещества, выделившаяся при прохождении одного кулона электричества, г/Кл; Q – количество электричества, Кл (Q = It, где I — сила тока, t — время, с).
Второй закон Фарадея. Одинаковое количество электричества выделяет при электролизе на электродах эквивалентные массы различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл, называемое числом Фарадея.
Тогда электрохимический эквивалент:
 ,
,
где M экв — молярная масса химического эквивалента вещества (иона)*, г/моль экв.
Из первого и второго законов Фарадея вытекает объединенное уравнение:
 ;
;
 . (4)
. (4)
Примеры решения задач
Пример 1. Написать уравнения электрохимических процессов, происходящих на аноде (анод инертный) и катоде при электролизе раствора бромида меди (II).
Решение. В водном растворе CuBr2 диссоциирует следующим образом:
CuBr2 ← → Cu2+ + 2Br –.
Стандартный электродный потенциал водородного электрода в нейтральной водной среде:
2H2O + 2 ē → H2↑ + 2OH– (–0,41В).
Это значительно отрицательнее потенциала системы:
Cu2+ + 2e → Cu0 (+0,34В).
Поэтому на катоде будет происходить электрохимическое осаждение меди:
Cu2+ + 2 ē → Cu0.
На аноде будет происходить окисление ионов брома, приводящее к выделению газообразного брома:
Br – – ē → Br0;
2Br0 → Br2↑;
поскольку электрохимическое окисление воды:
2H2O – 4e → O2↑ + 4H+
из нейтральных сред может протекать при потенциалах не менее (+1,23 В), что выше стандартного электродного потенциала, характеризующего выделение газообразного брома (+1,07 В).
Пример 2. Написать уравнения электрохимических процессов, происходящих на аноде и катоде при электролизе раствора сульфата натрия (анод инертный).
Решение. В водном растворе Na2SO4 диссоциирует следующим образом:
Na2SO4 ← → 2Na+ + SO42–.
Стандартный электродный потенциал системы:
Na+ + ē → Na0 (–2,71 В)
значительно отрицательнее потенциала водородного электрода в нейтральной среде (–0,41 В). Поэтому на катоде будет происходить электрохимическое разложение воды с выделением водорода:
2H2O + 2 ē → H2↑ + 2OH–,
а ионы натрия, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O – 4e → O2↑ + 4H+,
поскольку отвечающей этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему:
2SO42– – 2 ē → S2O82–.
Сульфат-ионы, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Пример 3. Написать уравнения электрохимических процессов, происходящих на катоде и аноде при электролизе раствора сульфата цинка с цинковым анодом.
Решение. В водном растворе ZnSO4 диссоциирует следующим образом:
ZnSO4 ← → Zn2+ + SO42–.
Стандартный электродный потенциал системы:
Zn2+ + 2 ē → Zn0 (–0,76 В)
близок к потенциалу водородного электрода в нейтральной водной среде (– 0,41 В), поэтому на катоде будут совместно протекать два процесса восстановления:
Zn2+ + 2 ē → Zn0;
2H2O + 2 ē → H2↑ + 2OH–.
На аноде возможно протекание трех окислительных процессов: электрохимического окисления воды, приводящего к выделению кислорода (+1,23 В), окисления сульфат-ионов (+2,01 В) и окисления материала анода, т.е. цинка (–0,76 В). Сравнение электродных потенциалов систем позволяет сделать вывод об окислении анода и выделении ионов цинка в раствор:
Zn0 – 2 ē → Zn2+.
Пример 4. Определить массу цинка, которая выделится на катоде при электролизе сульфата цинка в течение одного часа при токе 26,8 А, если выход по току цинка равен 50 %.
Решение. Расчет ведем согласно объединенному уравнению из законов Фарадея (4). Масса моля эквивалента (химический эквивалент вещества) цинка в ZnSO4 равна (65,38 / 2) = 32,69 г/моль экв. Не забыв выразить время в секундах, подставим в уравнение закона Фарадея все известные значения и определим массу цинка, которая должна выделиться (при условии, если весь ток будет израсходован на выделение цинка):
m = (32,69 ∙ 26,8 ∙ 3600) / 96485 = 32,69 г.
Так как выход по току цинка составляет 50%, то практически на катоде выделится цинка:
m пр = 32,69 ∙ (50/100) = 16,345 г.
Пример 5. Рассчитать ток при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях.
Решение. Из формулы (4) выразим силу тока:
 .
.
Так как количество водорода дано в единицах объема, то отношение m /Э заменяем отношением V H2/ V экв H2 , где V H2— объем водорода, л; V экв H2— объем одного моля эквивалента водорода.
Объем моля эквивалента водорода при нормальных условиях равен половине моля молекул водорода V экв H2= 22,4/2 = 11,2 л, так как моль любого газа в нормальных условиях занимает объем, равный 22,4 л, а в процессе электрохимического восстановления водорода участвуют два электрона. Подставив в приведенную формулу числовые значения, получим:
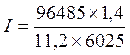 = 2 А.
= 2 А.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание работы:
1. После ознакомления с теоретическим материалом выполнить опыты и записать наблюдения.
2. Во всех опытах записать процессы окисления и восстановления на катоде и аноде и суммарную окислительно-восстановительную реакцию, происходящую в результате электролиза.
Опыт 1. Электролиз раствора серной кислоты
с медным анодом
Налить в стакан до ¾ его объема (до метки) 1 М раствор серной кислоты H2SO4. Закрыть стакан крышкой, в которой закреплены угольный и медный электроды, погрузив электроды в раствор. Подключить вилку с проводами от электродов к розетке, соединенной с аккумулятором, в соответствии с обозначениями «+» и «–» на вилке и розетке. Угольный электрод соединен с отрицательным полюсом источника тока (катод), медный электрод — с положительным полюсом (анод). Наблюдать за процессом, протекающем на катоде во время электролиза, и за поведением анода. Обратить внимание на то, что в начале опыта на катоде выделяются пузырьки газа. Затем, по мере окрашивания раствора в голубой цвет, скорость выделения газа уменьшается и одновременно катод начинает покрываться слоем меди. Дать объяснение этим явлениям. Составить уравнения реакций, протекающих на катоде и аноде. После опыта промыть стакан и электроды под струей воды из крана.
Опыт 2. Электролиз раствора иодида калия
с нерастворимым анодом
Налить в U -образную трубку 0,5 М раствор иодида калия. Вставить в оба колена трубки угольные электроды. Подключить вилку с проводами от электродов к розетке в соответствии с обозначениями на вилке и розетке. Если по проводам нельзя установить, какой из электродов соединен с отрицательным полюсом, а какой с положительным, это можно сделать по наблюдаемым процессам. В анодном пространстве наблюдается появление желтой окраски (выделяется свободный Br2). На катоде происходит выделение пузырьков газа.
В катодное пространство добавить несколько капель фенолфталеина и наблюдать появление малиновой окраски раствора. Составить уравнения реакций, протекающих на электродах. После опыта промыть трубку и электроды.
Опыт 3.Электролиз раствора сульфата натрия
с нерастворимым анодом
Налить в U -образную трубку 0,5 М раствор сульфата натрия. Вставить в оба колена трубки угольные электроды. Подключить вилку с проводами от электродов к розетке в соответствии с обозначениями на вилке и розетке. Если по проводам нельзя установить, какой из электродов является анодом, а какой катодом, сделать это по наблюдаемым процессам.
На обоих электродах наблюдается выделение пузырьков газа. Через три-четыре минуты после начала процесса в катодное и анодное пространства добавить по нескольку капель фиолетового лакмуса. В катодном пространстве лакмус окрасится в синий цвет, а в анодном пространстве приобретет красную окраску. Составить уравнения реакций, протекающих на электродах. После опыта промыть трубку и электроды.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется электролизом?
2. Какие процессы протекают на катоде и аноде при проведении электролиза?
3. Какова последовательность разряда ионов при электролизе на катоде? На аноде?
4. Как протекает электролиз с растворимым и нерастворимым анодами?
5. Какие процессы окисления и восстановления протекают на катоде и аноде при электролизе водного раствора хлорида никеля, если: а) анод угольный и б) анод никелевый?
6. Какие процессы окисления и восстановления протекают на катоде и аноде при электролизе водных растворов KNO3, AgBr, CdSO4, если анод платиновый?
7. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 часа при силе тока 4 А, если выход по току составляет 70%?
8. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделилось 11,742 г металла.
ЛАБОРАТОРНАЯ РАБОТА
«КОРРОЗИЯ МЕТАЛЛОВ»
Цель работы: изучение процессов химической и окислительно-восстановительной коррозии металлов
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Общие положения
Коррозия металлов (от лат. corrosio — разъедание) — самопроизвольный процесс разрушения металлов в результате физико-химического взаимодействия с окружающей средой.
Коррозия металлов — нежелательный процесс, в результате которого происходит потеря значительного количества металла. Еще больший вред приносит выход из строя металлических конструкций, сложной аппаратуры и приборов. Существенными бывают и косвенные потери, к которым можно отнести утечки нефти и газа из подвергающихся коррозии трубопроводов, простой оборудования и т. д. Изучение причин, вызывающих коррозию, и установление влияния различных факторов на скорость коррозии имеют своей практической целью защиту металлов и сплавов от коррозионного разрушения при их обработке и эксплуатации.






