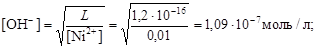Задание XIII. Написать в молекулярном и ионном виде реакции взаимоусиления гидролиза
613. Ацетат меди + сульфит лития.
614. Ацетат свинца + карбонат натрия.
615. Ацетат цинка + сульфит натрия.
616. Нитрат алюминия + карбонат натрия.
617. Нитрат висмута + сульфид калия.
618. Нитрат железа (III) + сульфид рубидия.
619. Нитрат свинца + карбонат стронция.
620. Нитрат серебра + карбонат натрия.
621. Нитрат хрома (III) + сульфид калия.
622. Сульфат алюминия + сульфид натрия.
623. Сульфат бария + сульфит цезия.
624. Сульфат кобальта + карбонат калия.
625. Сульфат олова + карбонат цезия.
626. Формиат алюминия + карбонат натрия.
627. Формиат меди + сульфит лития.
628. Формиат цинка + сульфид лития.
629. Фторид алюминия + карбонат калия.
630. Хлорид железа (II) + сульфид натрия.
631. Хлорид магния + сульфит рубидия.
632. Хлорид марганца + сульфит натрия.
633. Хлорид никеля + карбонат цезия.
Задание XIV. Найти неизвестные величины в предложенных задачах, дополнив табл.4.8.
Таблица 4.8
| Номер задачи | Электролит | Концентрация раствора | рН | b | Плотность раствора, г/см3 |
| Na2SO3 | 0,008 М | ? | ? | - | |
| Pb(NO3)2 | ? | 5,25 | ? | - | |
| Na2CO3 | 0,006 н. | ? | ? | - | |
| Na2C2O4 | 0,02 М | ? | ? | - | |
| Na3PO4 | 0,02 М | ? | ? | - | |
| C6H5ONa | ? | ? | 5 % | - | |
| Na2S | 0,03 М | ? | ? | - | |
| (NH4)2SO4 | ? | 5,48 | ? | - | |
| NaNO2 | 0,02 н. | ? | ? | - | |
| K2C2O4 | 0,008 М | ? | ? | - | |
| C6H5OK | ? | ? | 0,02 % | - | |
| K2HPO4 | ? | 7,5 | ? | - | |
| [NH3OН]Cl | ? | 5,5 | ? | - | |
| Na2S | 0,01 М | ? | ? | - | |
| ZnSO4 | 2 % | ? | ? | 1,019 | |
| Na2CO3 | ? | 11,2 | ? | - | |
| (CH3COO)2Ba | 0,005 М | ? | ? | - |
Окончание табл.4.8
| Номер задачи | Электролит | Концентрация раствора | рН | b | Плотность раствора, г/см3 |
| Na3PO4 | 0,03 н. | ? | ? | - | |
| CdSO4 | 3 % | ? | ? | 1,028 | |
| KCN | 0,02 М | ? | ? | - | |
| CuSO4 | 0,1 М | ? | ? | - | |
| ZnCl2 | ? | 5,84 | ? | - | |
| Na2C2O4 | 0,02 М | ? | ? | - | |
| K2HPO4 | 0,03 М | ? | ? | - | |
| HCOONa | 0,02 М | ? | ? | - | |
| Na2CO3 | ? | ? | 0,5 % | - | |
| CdSO4 | ? | 5,6 | ? | - | |
| NaBO2 | 1 г/л | ? | ? | - | |
| NaNO2 | 5 % | ? | ? | 1,01 | |
| NH4Cl | ? | 5,48 | ? | - | |
| ZnCl2 | 2 % | ? | ? | 1,016 | |
| CH3COONa | 0,01 М | ? | ? | - | |
| HCOONa | 1 % | ? | ? | 1,03 | |
| NH4Cl | % | 5,63 | ? | 1,02 | |
| KCN | 0,002 н. | ? | ? | - | |
| C6H5OK | 0,2 М | ? | ? | - | |
| HCOOK | 1 мол. % | ? | ? | 1,02 | |
| CH3COONa | ? | 8,72 | ? | - | |
| NH4Cl | ? | 5,41 | ? | - | |
| C6H5ONa | ? | ? | 5,6 % | - | |
| HCOONa | 0,01 н. | ? | ? | - | |
| NH4CN | ? | 9,175 | ? | - | |
| CH3COONH4 | ? | ? | 0,563 % | - | |
| CrCl3 | 2 % | ? | ? | 1,014 | |
| Na2Se | 11,36 % | ? | ? | 1,1 | |
| Na2SiO3 | 1 г/л | ? | ? | - | |
| Na3BO3 | 1 г/л | ? | ? | - | |
| K2GeO3 | 18,22 % | ? | ? | 1,1 | |
| NaBrO | 1 М | ? | ? | - | |
| CoCl2 | 2,6 % | ? | ? | 1,02 |
4.5. Равновесия в буферных растворах
Буферные растворы – растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Буферное действие основано на связывании добавляемых ионов Н + или ОН - в молекулы малодиссоциированных соединений.
Различают следующие типы буферных растворов:
· Смесь слабой кислоты и ее соли (например, уксусная кислота СН3СООН + ацетат натрия NaCH3COO). При добавлении сильной кислоты к этому раствору анионы соли связывают ионы Н + в молекулы малодиссоциированной уксусной кислоты:
СН3СОО- + Н+ Û СН3СООН.
При добавлении щелочи протекает реакция нейтрализации:
СН3СООН + ОН- Û СН3СОО- + Н2О
и раствор имеет
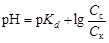 ,
,
где p Kd – показатель константы диссоциации слабой кислоты, p Kd = –lg Kd; С с и С к – концентрации соли и килоты соответственно, моль/л.
· Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты (например, Na2CO3 + NaHCO3 или Na2HPO4 + NaH2PO4). Анионы кислой соли реагируют подобно слабой кислоте:
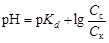 , (4.22)
, (4.22)
где С с и С к – концентрации кислой и средней соли соответственно, моль/л.
· Кислые соли слабых многоосновных кислот, при добавлении к растворам которых сильных кислот или щелочей, протекают аналогичные реакции:
НСО3- + Н+ Û Н2СО3;
НСО3- + ОН- Û СО32- + Н2О;
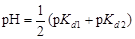 ,
,
где p Kn – показатель константы диссоциации кислоты по соответствующей ступени.
· Смесь слабого основания и его соли (например, NH4OH + + NH4Cl). Буферное действие основано на реакциях
NH4OH + H+ Û NH4+ + H2O;
NH4+ + OH- Û NH4OH.
Показатель
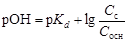 ,
,
где p Kd – показатель константы диссоциации слабого основания; С с и С осн – концентрации соли и основания соответственно, моль/л.
· Соли слабых кислот и слабых оснований (например, NH4CH3COO). Буферное действие обусловлено реакциями
NH4+ + OH- Û NH4OH;
CH3COO- + H+ Û CH3COOH.
Емкостью буферного раствора В называют количество сильной кислоты или щелочи, которое требуется добавить к 1 л раствора для изменения его рН на единицу. Раствор утрачивает буферные свойства при добавлении сильной кислоты или щелочи в количестве, превышающем буферную емкость. Различают буферную емкость раствора по кислоте и по щелочи.
Емкость кислого буфера по щелочи вычисляют по уравнению
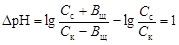 .
.
Таким образом,
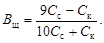 (4.23)
(4.23)
Из уравнения
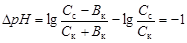
вычислим емкость кислого буфера по кислоте
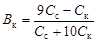 . (4.24)
. (4.24)
Емкости основного буфера по кислоте и по щелочи соответственно
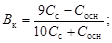
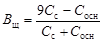 .
.
Отношение С с/ С к или С с/ С осн выбирают в пределах 0,1 < С с / С к < 10. По таблицам констант диссоциации (см. прил.1) подбирают слабую кислоту с p Kd = pH ± 1(или слабое основание с p Kd = pOH ± 1). Исходя из заданного рНвычисляют отношение концентраций С с / С к (или С с / С осн).
Пример 22. Вычислить изменение рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли, после добавления к 1 л раствора 0,1 моль соляной кислоты.
Решение. Вычислим рН данного буферного раствора по формуле (4.22):
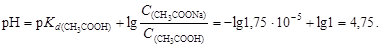
После добавления к буферному раствору соляной кислоты концентрация ацетата натрия уменьшится, а концентрация уксусной кислоты увеличится на 0,1 моль/л вследствие протекания реакции
CH3COONa + HCl ® CH3COOH + NaCl.
Вычислив для нового раствора
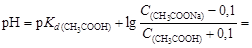
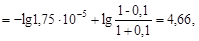
найдем ΔрН = 4,75 - 4,66 = 0,09.
Пример 23. К 0,8 л 0,5 М раствора НСООН (Kd = 1,8×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера и его буферную емкость по кислоте и щелочи.
Решение. Количество вещества НСООН и NaOH соответственно
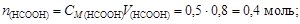
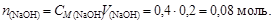
Объем буферного раствора
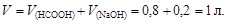
Количество вещества формиата натрия, образующегося по реакции NaOH + HCOOH ® HCOONa + H2O, 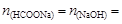
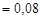 моль. Молярная концентрация формиата натрия в буферном растворе
моль. Молярная концентрация формиата натрия в буферном растворе
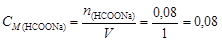 моль/л.
моль/л.
Остаточное количество вещества муравьиной кислоты
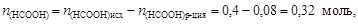
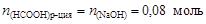 .
.
Ее молярная концентрация в буферном растворе
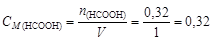 моль/л.
моль/л.
Буферный раствор имеет
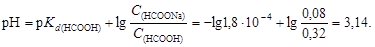
Буферная емкость по кислоте согласно уравнению (4.24)
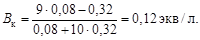
Буферную емкость по щелочи определим при помощи уравнения (4.23):
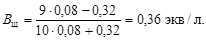
Пример 24. Сколько граммов твердого формиата натрия HCOONa надо добавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3?
Решение. При добавлении к раствору соляной кислоты формиата натрия образуется муравьиная кислота по реакции HCOONa + HCl ® HCOOH + NaCl. Ее концентрация
С (HCOOH) = С (HCl) = 0,2 моль/л.
Для образования формиатного буферного раствора необходима определенная концентрация формиата натрия, которую найдем исходя из формулы (4.22):
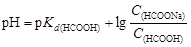 ,
,
откуда 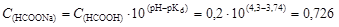 моль/л.
моль/л.
Количество вещества формиата натрия, необходимого для получения данного буферного раствора,
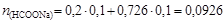 моль,
моль,
его масса
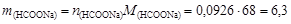 г.
г.
Задание XV. Решить задачи.
684. К 200 мл 0,5 н. раствора уксусной кислоты добавили 10 мл 0,8 н. раствора едкого натра. Определить рН полученного раствора.
685. Какой объем 20-процентного раствора уксусной кислоты плотностью 1,026 г/см3 следует прилить к 1 л 0,075 н. раствора ацетата натрия, чтобы получить буферный раствор с рН = 2,75?
686. Рассчитать рН раствора, содержащего 1,5 моль/л ацетата натрия и 0,75 моль/л уксусной кислоты. Как изменится величина рН при добавлении к 50 мл этого раствора 1 мл 2 н. раствора едкого натра?
687. Сколько граммов безводного бензойнокислого натрия необходимо прибавить к 100 мл 0,02 моль/л раствора бензойной кислоты С6Н5СООН, чтобы получить буферный раствор с рН = 5?
688. К 25 мл 2-процентного раствора гидроксида аммония плотностью 0,99 г/см3 добавили 1,5 г хлорида аммония. Определить рН полученного раствора, если его плотность равна 1,01 г/см3.
689. Как изменится рН в 0,1 н. растворе уксусной кислоты после добавления к нему кристаллического ацетата натрия до концентрации 0,1 моль/л?
690. Как изменится рН раствора, полученного смешиванием 100 мл 5-процентного раствора муравьиной кислоты плотностью 1,008 г/см3 и 100 мл 7-процентного раствора формиата калия плотностью 1,01 г/см3, если к нему прилить 50 мл 0,2 н. раствора едкого калия?
691. Какой объем 20-процентного раствора фосфорной кислоты (плотность 1,113 г/мл) надо добавить к 2 л раствора едкого кали с концентрацией 0,2 моль/л для получения буферного раствора с рН = 6?
692. Как изменится рН раствора, содержащего в 200 мл 2,14 г хлорида аммония и 2,1 г гидроксида аммония, в результате добавления к нему 10 мл 2 н. раствора соляной кислоты?
693. Какой объем раствора гидроксида бария концентрацией 0,5 моль/л следует добавить к 1,5 л 5-процентного раствора уксусной кислоты плотностью 1,006 г/см3, чтобы получить буферный раствор с рН = 4?
694. Рассчитать рН раствора, полученного смешиванием 10 м3 2-процентного раствора едкого натра (плотность 1,021 г/см3) и 15 м3 5-процентного раствора фосфорной кислоты (плотность 1,026 г/см3).
695. Какой объем 20-процентной серной кислоты (плотность 1,139 г/мл) необходимо добавить к 5 л раствора этиламина с концентрацией 0,02 моль/л для получения буферного раствора с рН = 9,8?
696. К 5 л 5-процентного раствора гидроксида аммония плотностью 0,986 г/мл добавили 10 л 3-процентного раствора серной кислоты плотностью 1,019 г/мл. Определить рН полученного раствора.
697. Определить рН борно-натриевого буферного раствора (концентрация Н3ВО3 и NaH2BO3 15 и 10 % соответственно, средняя плотность раствора 1,12 г/см3).
698. Рассчитать рН раствора, полученного путем поглощения 20 л углекислого газа 6 л раствора едкого натра с концентрацией 0,1 моль/л. Процесс вели при температуре 25 °С и давлении 1 атм.
699. Определить рН фосфорно-натриевого буфера, если в 1 л раствора содержится 19,6 г фосфорной кислоты и 30 г дигидрофосфата натрия.
700. Объем хлористого водорода, равный 5 м3, был измерен при температуре 100 °С и давлении 1,5 атм. Определить рН раствора, полученного в результате поглощения этого газа 5 м3 раствора гидроксида аммония с концентрацией 0,1 моль/л.
701. Рассчитать рН раствора, в 1 л которого содержится 12,5 г ацетата натрия и 17,5 г уксусной кислоты.
702. Какой объем аммиака должен быть поглощен при 25 °С и давлении 1 атм 2-процентным раствором серной кислоты плотностью 1,012 г/мл в количестве 300 мл, чтобы полученный раствор имел рН = 10?
703. Каков рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония?
704. Какой объем раствора аммиака (концентрация 4,27 %, плотность 0,98 г/см3) надо добавить к 200 мл 0,1 н. раствора соляной кислоты, чтобы получить буферный раствор с рН = 8,24?
705. Рассчитать рН смеси карбоната и гидрокарбоната калия с концентрацией по 0,02 моль/л.
706. Какой объем раствора уксусной кислоты (концентрация 6 %, плотность 1,007 г/см3) следует долить к 100 мл раствора едкого натра (концентрация 0,6 %, плотность 1,005 г/см3), чтобы получить буферный раствор с рН = 4,18?
707. Рассчитать рН раствора дигидрофосфата натрия с концентрацией 1 моль/л.
708. Сколько граммов гипобромита натрия NaBrO следует добавить к 10 л 0,5 н. раствора бромноватистой кислоты, константа диссоциации которой равна 2,06×10-9, чтобы получить буферный раствор с рН = 6,74?
709. Рассчитать рН раствора гидросульфида калия с концентрацией 1 моль/л.
710. Какой объем аммиака должен быть поглощен при 25 °С и давлении 1 атм 2-процентным раствором соляной кислоты (плотность 1,008 г/см3) в количестве 300 мл, чтобы полученный раствор имел значение рН = 10?
711. Каково значение рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония?
712. Как изменится рН СН3СООН в 0,2 М растворе, если к 100 мл этого раствора прибавили 30 мл 0,3 М раствора ацетата натрия?
713. Рассчитать рН полученного раствора, если к 100 мл 0,0375 М СН3СООН прибавили 0,102 г CH3COONa.
714. Вычислить рН раствора, полученного смешиванием 25 мл 0,2 М СН3СООН и 15 мл 0,1 М CH3COONa.
715. Вычислить рН полученного раствора, если в 1 л воды содержится 60,05 г СН3СООН и 82,03 г CH3COONa.
716. Вычислить рН раствора, если к 2 л воды прибавили 23 г НСООН и 21 г НСООК.
717. Вычислить рН раствора, полученного смешиванием 15 мл 0,1 М НСООН и 12 мл 0,2 М HCOONa.
718. Какой объем 0,2 М NaOH надо прибавить к 40 мл 0,1 М раствора лимонной кислоты, чтобы получить раствор с рН = 3,0?
719. Какой объем раствора NaOH (концентрация 0,4 %) надо прибавить к 23 мл 0,2 М раствора ортофосфорной кислоты, чтобы получить раствор с рН = 2,3?
720. Какую массу гидроксида натрия надо растворить в 100 мл 0,1 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10?
721. Какую массу гидрокарбоната натрия надо растворить в 30 мл раствора гидроксида натрия (концентрация 1 %), чтобы получить раствор с рН = 10,0?
722. Как изменится рН 1-процентного раствора НСООН, если к 230 мл этого раствора прибавить 540 мл раствора НСООK концентрацией 0,5 %?
723. Сколько миллилитров 0,2 М HCl надо добавить к 50 мл 0,1 М Na2CO3, чтобы получить раствор с рН = 10,5?
4.6. Равновесия в насыщенных растворах
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора.
Рассмотрим равновесие между солью, состоящей из катионов металла Mz + и анионов кислотного остатка Az -, и ее насыщенным раствором. При этом учтем, что все соли – сильные электролиты, полностью диссоциирующие в растворе:
Мn+Аn-(т) Û n+М z +(р-р) + n-А z -(р-р). (4.25)
Константу данного равновесия называют произведением растворимости соли и обозначают L. Согласно закону действующих масс
L = [M z +] n +[A z -] n -. (4.26)
Это выражение используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно берут в справочнике (прил.3).
Бинарная система соль – вода. Согласно уравнению (4.25), [M z +] = n +S и [A z -] = n- S. Подставив эти соотношения в (4.26), получим
L = (n +S)n + (n -S)n - = (n± S)n,
где n± = (n+n+×n-n-)1/n; n = n+ + n-.
Таким образом, растворимость соли в воде
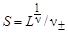 .
.
Многокомпонентная система с одноименными ионами. Рассмотрим расчет растворимости соли Мn+Аn - в системе, содержащей хорошо растворимую соль М¢Аn¢ с одноименным анионом (например, BaSO4–Na2SO4–H2O). Катионы M z + переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: [M z +] = n+ S. Концентрация анионов в растворе складывается из двух составляющих: растворимости труднорастворимой соли n -S и концентрации соли М¢An¢, которую обозначим n¢ С ¢. После подстановки в формулу (4.26) запишем
L = ( n+ S) n+ ( n- S + n¢ C ¢ ) n -. (4.27)
Растворимость находят путем решения степенного уравнения (4.27). Если растворимость меньше концентрации соли с одноименным ионом в 100 раз и более, т.е. n- S < 0,01n¢ C ¢, то пренебрегают меньшим слагаемым в сумме и получают
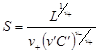 .
.
Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается.
Условия образования осадков. Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, т.е. правая часть в формуле (4.26) больше левой, то в системе образуется осадок. При противоположном знаке неравенства осадок будет растворяться.
Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют формулы
М(ОН)z(т) Û М z +(р-р) + z OH-(р-р);
L = [M z +][OH-] z. (4.28)
Из формулы (4.28) находят концентрацию ионов гидроксила, а затем рН гидратообразования.
Пример 25. Рассчитать растворимость флюорита CaF2 в воде и в растворе NaF (концентрация 0,1 моль/л).
Решение. 1. Запишем уравнение диссоциации CaF2, отвечающее равновесному растворению флюорита:
CaF2(т) ® Сa2+(p-p) + 2F-(p-p),
согласно которому [Ca2+] = S; [F-] = 2 S.
Составим уравнение произведения растворимости CaF2
L = [Ca2+][F-]2 = S×(2 S)2 = 4 S 3,
из которого растворимость флюорита в воде
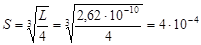 моль/л.
моль/л.
2. Для расчета растворимости в растворе NaF, которую обозначим S 1, произведем следующие подстановки в уравнение произведения растворимости L = [Ca2+][F-]2: [Ca2+] = S 1; [F-] = 2 S 1 + + C NaF = 0,1 моль/л, так как S 1 << 0,1. Тогда L = S 1(0,1)2, откуда
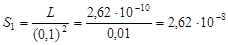 моль/л.
моль/л.
Пример 26. Вычислить рН гидратообразования для раствора сульфата никеля с концентрацией 0,01 моль/л (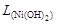 = 1,2×10-16).
= 1,2×10-16).
Решение. Осадок гидроксида образуется из раствора NiSO4 в результате установления следующего равновесия:
Ni(OH)2 ® Ni2+ + 2OH-.
Гидратообразование начинается при условии [Ni2+]×[OH-]2 = L, откуда