81. Сколько граммов хлористого аммония потребуется для приготовления 600 мл 0,5 М раствора?
82. Какую массу нитрата свинца (II) надо взять для приготовления 300 мл 0,2 н. раствора?
83. Сколько граммов медного купороса (пентагидрата сульфата меди (II)) надо взять для приготовления 1 л 2 н. раствора?
84. Какой процентной концентрации получится соляная кислота, если к 100 мл раствора HCl (концентрация 36 %, плотность 1,179 г/см3) прибавить 200 мл воды?
85. Сколько граммов азотной кислоты содержится в 1 л 36-процентного раствора плотностью 1,221 г/см3?
86. Какой процентной концентрации получится раствор, если к 500 мл 30-процентного раствора КОН плотностью 1,288 г/см3 прибавить 500 мл воды?
87. Какой объем аммиака следует растворить в воде при 25 °С и 120 кПа для получения 2 л 10-процентного раствора гидроксида аммония, плотностью 0,96 г/см3?
88. Какая масса сульфита натрия потребуется для приготовления 5 л 8-процентного раствора плотностью 1,075 г/см3?
89. Сколько воды надо прибавить к 50 мл 2 М раствора ортофосфорной кислоты, чтобы получить 0,25 н. раствор?
90. Какой объем воды потребуется для растворения 67,2 л хлороводорода, приведенного к нормальным условиям, для получения 9-процентного раствора плотностью 1,04 г/мл?
91. Сколько граммов десятиводного сульфата натрия нужно растворить в 800 мл воды для получения раствора с концентрацией по безводному сульфату натрия 10 %?
92. Какая масса хлорида калия потребуется для приготовления 200 мл раствора с концентрацией 1,455 моль/л?
93. Необходимо приготовить 100 г раствора хлорида бария с концентрацией 5 %. Какая масса дигидрата хлорида бария потребуется для этого?
94. Какой объем раствора серной кислоты (концентрация 30 %, плотность 1,12 г/см3) потребуется для приготовления 2 л раствора концентрацией 0,4 н.?
95. Какой объем аммиака при температуре 25 °С и давлении 1 атм следует растворить в 1 л воды для получения раствора гидроксида аммония концентрацией 20 %?
96. Рассчитать, какой объем воды следует взять для растворения 16 г СН3ОН для получения раствора метанола с мольной долей 0,02.
97. Раствор хлорида алюминия в воде имеет концентрацию 2 экв/л и плотность 1,08 г/см3. К 50 г этого раствора добавили 35 мл воды, и его плотность стала 1,035 г/см3. Найти массовую долю хлорида алюминия в новом растворе.
98. Сколько 5-процентного раствора можно приготовить из 1 т плавленого сульфида натрия, содержащего 30 % примесей?
99. Раствор хлорида алюминия в воде имеет концентрацию 2,18 экв/л и плотность 1,08 г/см3. К 50 г этого раствора добавили 35 мл воды и его плотность стала 1,044 г/см3. Найти концентрацию нового раствора в процентах.
100. К 200 мл 0,7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты в граммах на литр.
101. Смешали 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. Какое вещество и в каком количестве будет находиться в растворе в избытке?
102. Раствор хлорида бария содержит 2,3 г бария. Сколько миллилитров 0,5 н. раствора серной кислоты потребуется для осаждения всего бария в виде сульфата?
103. Сколько и какого вещества останется в избытке, если к 75 мл 0,3 н. раствора серной кислоты прибавить 125 мл 0,2 н. раствора калиевой щелочи?
104. Для осаждения в виде хлорида всего серебра, содержащегося в 100 мл раствора нитрата серебра, потребовалось 50 мл 0,2 н. раствора соляной кислоты. Какова нормальность раствора нитрата серебра, и какая масса хлорида серебра выпала в осадок?
105. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равна нормальность раствора серной кислоты?
106. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г гидроксида натрия в 40 мл?
107. На нейтрализацию 1 л раствора, содержащего 1,4 г гидроксида калия, требуется 50 мл раствора кислоты. Вычислить нормальность раствора кислоты.
108. Какая масса азотной кислоты содержалась в растворе, если на нейтрализацию его потребовалось 35 мл 0,4 н. раствора гидроксида натрия?
109. Сколько миллилитров 1 н. раствора едкого натра потребуется для полной нейтрализации 300 мл 0,1 М раствора серной кислоты?
110. Смешали 1 л раствора соляной кислоты (концентрация 20 %, плотность 1,098 г/см3) и 1 л раствора соляной кислоты (концентрация 12,5 %, плотность 1,06 г/см3). Какой молярной концентрации раствор получится после смешивания?
111. Сколько миллилитров 0,1 н. едкого натра (NaOH) потребуется для осаждения меди в виде гидроксида из 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди?
112. Сколько миллилитров соляной кислоты (концентрация 10 %, плотность 1,047 г/ см3) потребуется для нейтрализации раствора, содержащего 8,5 г гидроксида бария?
113. Сколько миллилитров раствора соды, содержащего в 1 л 21,2 г соли, надо добавить к 30 мл 0,2 н. раствора хлорида кальция для полного осаждения кальция в виде карбоната?
114. Сколько граммов гидроксида железа выпадет в осадок, если к 500 мл 0,2 н. раствора хлорида железа (III) добавить избыток щелочи?
115. В каком объемном отношении надо смешать растворы гидроксида бария с концентрацией 95,5 г/л и 0,5 н. соляной кислоты для получения раствора с нейтральной средой?
116. На нейтрализацию 20 мл раствора едкого кали потребовалось 13 мл 0,2 н. раствора кислоты. Сколько граммов едкого кали содержится в 1 л раствора?
117. Сколько миллилитров раствора нитрата серебра, содержащего 5 г/л серебра, надо добавить к 10 мл 0,2 н. раствора хлорида натрия, чтобы полностью удалить из раствора ионы хлора?
118. Сколько миллилитров 2 н. серной кислоты потребуется для превращения 1,56 г гидроксида алюминия в сульфат алюминия?
119. Сколько граммов карбоната кальция можно растворить в 100 мл соляной кислоты (концентрация 20 %, плотность 1,1 г/см3)? Вычислить объем, который займет выделившийся газ при нормальных условиях.
120. К 5 г цинка прибавили 100 мл 10,2-процентной соляной кислоты (плотность раствора 1,05 г/см3). Какое вещество и в каком количестве осталось в избытке? Вычислить объем водорода, выделившегося при 20 ºС и 750 мм рт. ст.
121. На нейтрализацию 20 мл раствора гидроксида калия (концентрация 5,66 %, плотность 1,053 г/см3) пошло 12,1 мл раствора серной кислоты плотностью 1,052 г/см3. Определить процентную концентрацию раствора серной кислоты.
122. Какое количество миллилитров 0,5 н. раствора сульфата натрия надо долить к 100 мл раствора хлорида бария (концентрация 16 %, плотность 1,156 г/см3), чтобы полностью осадить сульфат-ион?
123. На нейтрализацию 50 мл раствора фосфорной кислоты плотностью 1,01 г/см3 израсходовано 31,2 г 1 н. раствора гидроксида натрия плотностью 1,04 г/см3. Определить процентную концентрацию фосфорной кислоты.
124. 10 г сплава меди с цинком обработали соляной кислотой. При этом выделилось 570 мл водорода, измеренных при температуре 27 ºС и давлении 105 Па. Определить состав сплава и выразить его в массовых и мольных долях.
125. При растворении 15 г сплава серебра с алюминием раствором едкого натра выделилось 13 мл водорода, измеренного при температуре 57 ºС и давлении 15×105 Па. Определить состав сплава и выразить его в массовых и мольных долях.
126. При растворении в азотной кислоте 5 г сплава меди и золота выделилось 0,99 мл оксида азота (II), измеренных при температуре 37 ºС и давлении 1,2×105 Па. Определить состав сплава и выразить его в массовых и мольных долях.
127. Для нейтрализации 20 мл 0,1 н. раствора кислоты потребовалось 8 мл раствора гидроксида натрия. Сколько граммов NaOH содержит 1 л этого раствора?
128. Какой объем 0,2 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,51 г гидроксида калия в 30 мл?
129. Сколько и какого вещества останется в избытке, если к 150 мл 0,4 н. раствора соляной кислоты прибавить 250 мл 0,2 н. раствора гидроксида натрия?
130. Смешали 100 мл 1,5 н. раствора и 100 мл 0,5 н. раствора серной кислоты. Рассчитать молярность полученного раствора.
131. К 100 мл раствора едкого натра (концентрация 10 %, плотность 1,109 г/см3) прибавили 200 мл раствора NaOH (концентрация 20 %, плотность 1,219 г/см3). Рассчитать нормальность полученного раствора.
132. К 500 мл раствора хлорида натрия (концентрация 6 %, плотность 1,04 г/см3) прибавили 1 л раствора хлорида калия концентрацией 8 % и плотностью 1,05 г/см3. Рассчитать молярную концентрацию хлорид-иона в растворе после смешения.
133. Смешали два раствора нитрата натрия концентрацией 0,8 и 0,2 моль/л в пропорции 2:1. Рассчитать молярную концентрацию полученного раствора.
134. Определить эквивалентную массу кислоты, если на нейтрализацию раствора, содержащего 0,63 г кислоты, израсходовано 20 мл 0,5 н. раствора щелочи.
135. Смешали 2 л раствора сульфата меди (II) концентрацией 2 % и плотностью 1,02 г/см3 и 1 л раствора хлорида меди (II) концентрацией 0,1 н. Рассчитать молярную концентрацию меди в полученном растворе.
136. К 50 мл раствора NaCl концентрацией 10 г/л прибавили 100 мл раствора NaCl концентрацией 2 г/л. Рассчитать молярную концентрацию полученного раствора.
137. К 100 л раствора соли железа с содержанием по железу 5 г/л прибавили 50 л раствора нитрата железа (III) концентрацией 0,3 моль/л. Рассчитать молярную концентрацию железа в полученном растворе.
138. На нейтрализацию раствора, содержащего 4,05 г кислоты, израсходовано 40 мл раствора едкого натра (NaOH) концентрацией 10 % и плотностью 1,109 г/см3. Определить эквивалентную массу кислоты.
139. К 50 л раствора фосфорной кислоты концентрацией 8 % и плотностью 1,042 г/см3 прибавили 2 л фосфата натрия концентрацией 5 г/л. Рассчитать молярную концентрацию фосфат-иона в полученном растворе.
140. Смешали 54 мл раствора NaOH концентрацией 0,5 % и плотностью 1 г/см3 и 10 мл 2-процентного раствора NaOH плотностью 1,02 г/см3. Рассчитать концентрацию полученного раствора (в процентах).
141. Смешали 120 л раствора с содержанием никеля 0,8 моль/л, 500 л раствора с содержанием никеля 1 г/л и 50 л раствора (концентрация NiSO4 14 %, плотность 1,158 г/см3). Рассчитать молярную концентрацию никеля в полученном растворе.
142. На нейтрализацию 10 мл раствора серной кислоты концентрацией 22 % и плотностью 1,155 г/см3 потребовалось 50 мл раствора щелочи концентрацией 41,6 г/л. Определить эквивалентную массу щелочи.
143. Смешали 4 мл серной кислоты (концентрация 40 %, плотность 1,303 г/см3) и 200 мл серной кислоты концентрацией 0,001 моль/л. Рассчитать нормальную концентрацию полученного раствора.
144. Смешали 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора той же кислоты концентрацией 2 г/л. Рассчитать концентрацию полученного раствора в граммах на литр.
145. Сколько известняка с содержанием карбоната кальция 70 % потребуется для полной нейтрализации 10 л серной кислоты концентрацией 5 г/л?
146. Смешали 7 л раствора магния концентрацией 0,1 моль/л и 5 л раствора соли кальция концентрацией по кальцию 4 г/л. Рассчитать общее содержание металлов в растворе (в молях на литр).
147. К раствору, содержащему 5 г сульфата цинка, объемом 2 л добавили 3 л раствора сульфата меди (II) концентрацией 0,3 моль/л. Рассчитать молярную концентрацию сульфат-иона в полученном растворе.
148. Смешали растворы нитрата аммония концентрацией 0,3 моль/кг и 0,08 моль/л в соотношении 1:3. Рассчитать моляльную концентрацию полученного раствора. Плотность всех растворов принять равной 1 г/см3.
149. К раствору объемом 30 мл, содержащему 10 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора. Найти молярную концентрацию вещества, которое останется в избытке.
150. Смешали раствор нитрата серебра (концентрация 1 %, плотность 1,01 г/см3) и раствор соляной кислоты (концентрация 5 %, плотность 1,02 г/см3) в соотношении 3:4. Рассчитать молярную концентрацию нитрат-иона в полученном растворе.
151. Какой объем раствора серной кислоты (концентрация 10 %, плотность 1,07 г/см3) потребуется для полной нейтрализации 0,5 л раствора NaOH концентрацией 16 г/л?
152. Смешали 10 мл раствора HCl (концентрация 10 %, плотность 1,047 г/см3) и 10 мл раствора HCl (концентрация 6 %, плотность 1,028 г/см3). Рассчитать массовую долю и молярную концентрацию соляной кислоты в полученном растворе.
153. Из раствора нитрата серебра (концентрация 2 %, плотность 1,015 г/см3) по реакции с хлоридом натрия образуется 14,35 г хлорида серебра. Вычислить исходный объем раствора нитрата серебра.
154. Смешали 1 л 1 М раствора CuSO4 и 2 л 0,5 М раствора CuSO4. Рассчитать содержание меди в полученном растворе в граммах на литр.
155. Сколько миллилитров 0,5 н. раствора сульфата натрия нужно добавить к 100 мл раствора хлорида бария (концентрация 16 %, плотность 1,156 г/см3), чтобы полностью осадить сульфат-ионы?
156. Металл вытеснил из 100 мл соляной кислоты 348 мл водорода, измеренного при 20 °С и 99,5 кПа. Рассчитать нормальную концентрацию хлорида металла в полученном растворе.
4.2. Коллигативные свойства растворов
Свойства растворов (температура замерзания и кипения, давление насыщенного пара, осмотическое давление) зависят от природы растворителя и концентрации раствора и называются коллигативными свойствами, так как не зависят от природы растворенного вещества.
Закон Рауля. Закон формулируется следующим образом: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе. Согласно закону, понижение парциального равновесного давления насыщенного пара растворителя над раствором является линейной функцией мольной доли растворенного вещества в растворе:
 (4.7)
(4.7)
или
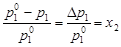 (при n 2 << n 1), (4.8)
(при n 2 << n 1), (4.8)
где  - давление насыщенного пара растворителя над раствором;
- давление насыщенного пара растворителя над раствором; 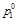 - давление насыщенного пара над индивидуальным растворителем; х 1 и х 2– мольные доли растворителя и растворенного вещества в растворе.
- давление насыщенного пара над индивидуальным растворителем; х 1 и х 2– мольные доли растворителя и растворенного вещества в растворе.
Изменение температур фазовых переходов растворов. Повышение температуры кипения
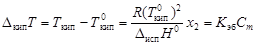 , (4.9)
, (4.9)
где 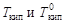 - соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; K эб – эбуллиоскопическая константа растворителя,
- соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; K эб – эбуллиоскопическая константа растворителя, 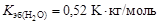 .
.
Изменение температуры кристаллизации
 , (4.10)
, (4.10)
где 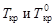 - соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; K кр – криоскопическая постоянная растворителя,
- соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; K кр – криоскопическая постоянная растворителя,  .
.
Осмотическое давление. Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану называется осмосом. Давление, которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением, которое можно вычислить по формуле
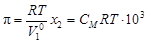 , (4.11)
, (4.11)
где 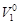 – объем 1 моль растворителя, м3.
– объем 1 моль растворителя, м3.
Для электролитов необходим поправочный множитель i, названный изотоническим коэффициентом:
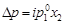 ; (4.12)
; (4.12)
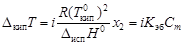 ;
;
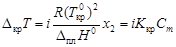 ;
;
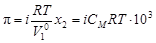 .
.
Изотонический коэффициент – показатель увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). При i > 1 протекает процесс диссоциации, при i < 1 – процесс ассоциации. Численное значение изотонического коэффициента позволяет вычислить степень диссоциациии ассоциации. Соответственно
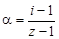 ;
; 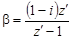 ,
,
где z – число частиц, получающихся из одной частицы при диссоциации; z ¢ – число частиц, объединяющихся в одну при ассоциации.
Пример 6. относительное понижение упругости пара над раствором тростникового сахара (С12Н22О11) в воде составляет 2 %. Определить осмотическое давление этого раствора при температуре 47 ºС. Плотность раствора 1,15 г/см3. Определить изменение температуры плавления и кристаллизации, если K эб = 0,52 K·кг/моль, K кр = = 1,86 K·кг/моль, 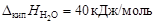 ;
; 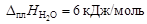 ;
; 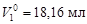 .
.
Решение. Из закона Рауля (4.7), (4.8) следует, что мольная доля сахара в растворе составляет 0,02. По формуле (4.9) определим повышение температуры кипения раствора:
 .
.
По формуле (4.10) понижение температуры замерзания раствора:
 .
.
вычислим осмотическое давление по формуле (4.11): 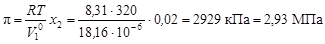 .
.
Пример 7. Раствор магния в олове содержит 0,833 г магния в 100 г олова. Температура плавления олова 505 К, а теплота плавления 7200 Дж/моль. Определить температуру начала кристаллизации этого раствора.
Решение. определим мольную долю х 2 магния в олове:
 .
.
по уравнению (4.10) вычислим температуру кристаллизации расплава:

Пример 8. В системе свинец (II)-серебро (I) при Т = 1490 К закон Рауля справедлив для растворов, содержащих менее 18 % свинца. Давление насыщенного пара над чистым серебром 7,47 Па. Вычислить давление пара серебра над раствором, содержащим 17,5 % свинца.
Решение. выделим мысленно 100 г расплава и примем их за 100 %, тогда  . мольная доля свинца в сплаве
. мольная доля свинца в сплаве
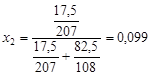 .
.
По уравнению (4.8) вычислим давление пара серебра над расплавом
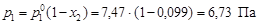 .
.
Пример 9. Давление насыщенного пара над раствором, содержащим 5 г едкого натра в 180 г воды, при 100 ºС составляет 0,99·105 Па. Давление насыщенного пара над чистой водой при 100 ºС составляет 1,01·105 Па. Определить состояние едкого натра в растворе.
Решение. Состояние едкого натра в растворе можно оценить по величине изотонического коэффициента i. По закону Рауля (4.8)
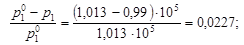
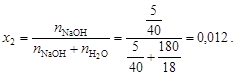
Из уравнения (4.12) вычислим
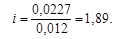
полученное значение i > 1 указывает на наличие диссоциации NaOH. Кажущаяся степень диссоциации
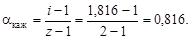
Задание III. Решить задачи.
157. Определить осмотическое давление раствора, содержащего 30 г глицерина в 120 г воды, если плотность этого раствора близка к единице, а температура 27 °С.
158. Определить осмотическое давление раствора хлорида натрия в воде концентрацией 5 %, если плотность раствора 1,04 г/см3, температура 17 °С. Кажущаяся степень диссоциации 95 %.
159. К 100 мл 0,5 М водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С?
160. При 293 K давление насыщенного пара над водой равно 2,34 кПа. Сколько граммов глицерина С3Н5(ОН)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па?
161. При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения раствора повысилась на 0,453 K. Определить молярную массу растворенного вещества.
162. В 60 г бензола растворено 2,09 г некоторого вещества, содержащего 50,69 % С, 4,23 % Н, 45,08 % О. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5 °С.
163. Температура кипения водного раствора сахарозы С12Н22О11 101,4°С. Вычислить молярную концентрацию и массовую долю сахарозы в растворе. При какой температуре этот раствор замерзает?
164. Определить осмотическое давление раствора хлорида бария в воде, если его концентрация 5 %, плотность 1,08 г/см3, температура 7 °С, кажущаяся степень диссоциации 97 %.
165. Определить кажущуюся степень диссоциации хлорида калия в его 0,1 н. водном растворе, если при температуре 27 °С осмотическое давление раствора 4,72×105 Па.
166. Осмотическое давление гипертонического раствора (водный раствор хлорида натрия концентрацией 10 %) при температуре 20 °С составляет 84×105 Па. Найти кажущуюся степень диссоциации соли в этом растворе, если его плотность 1,1 г/см3.
167. Установить концентрацию раствора сульфата натрия в воде и выразить ее всеми способами, если известно, что осмотическое давление раствора при температуре 15 °С составляет 32,5×105 Па, кажущаяся степень диссоциации 91 %.
168. Водный раствор соли хрома (III) имеет осмотическое давление 18,1×105 Па, плотность раствора 1,06 г/см3. Определить концентрацию раствора и выразить ее всеми способами, если соль диссоциирована нацело.
169. Сколько граммов хлорида кальция надо растворить в 1 л воды, чтобы полученный раствор при температуре 27 °С имел осмотическое давление 23,7×105 Па? Кажущаяся степень диссоциации 95 %.
170. Сколько граммов сульфата меди (II) надо растворить в 100 мл воды, чтобы при температуре 7 °С полученный раствор имел осмотическое давление 16×105 Па? Кажущаяся степень диссоциации 87 %.
171. Определить концентрацию хлорид-ионов в растворе хлорида ртути (II), если при температуре 17 °С и концентрации раствора 0,1 моль/л его осмотическое давление 2,62×105 Па.
172. Раствор роданида железа (III) в воде с концентрацией 0,5 моль/л при температуре 27 °С имеет осмотическое давление 15,5×105 Па. Определить концентрацию роданид-ионов в данном растворе.
173. Найти давление паров воды над раствором хлорида натрия концентрацией 5 %, если температура раствора 20 °С, кажущаяся степень диссоциации 98 %, 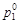 =2,3×105 Па.
=2,3×105 Па.
174. Определить молярную концентрацию раствора карбамида, если при температуре 35 °С давление паров воды над раствором оказалось на 2 % ниже, чем над индивидуальной водой (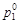 =5,55×105 Па). Карбамид в водных растворах не диссоциирует.
=5,55×105 Па). Карбамид в водных растворах не диссоциирует.
175. Вычислить кажущуюся степень диссоциации сульфата калия в его водном растворе концентрацией 3 %, если относительное понижение давления паров воды над раствором составляет 9,23×10-3Па.
176. Рассчитать давление паров воды над 0,5-процентным раствором хлорида бария при 15 °С, если кажущаяся степень диссоциации 96 %, 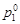 = 1,683×105 Па.
= 1,683×105 Па.
177. Определить концентрацию сульфата цинка в водном растворе, если относительное понижение давления пара над этим раствором 0,1 %, и соль диссоциирована нацело.
178. Какова концентрация хлорида алюминия в растворе, если относительное понижение давления пара над раствором 0,16 %, степень диссоциации соли 100 %?
179. Осмотическое давление раствора хлорида натрия при температуре 20 °С составляет 8,4×105 па. Определить давление паров воды над этим раствором, если плотность раствора 1,05 г/см3, кажущаяся степень диссоциации соли 92 %, 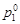 =2,31×103 Па.
=2,31×103 Па.
180. Раствор хлорида калия в воде имеет осмотическое давление 9,44×105 Па. Определить давление паров воды над этим раствором, если его температура 27 °С, плотность раствора 1,07 г/см3, кажущаяся степень диссоциации соли 92 %, 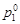 =3,5×105Па.
=3,5×105Па.
181. Определить давление паров воды над раствором глицерина С3Н5(ОН)3, если в 100 г воды растворено 20 г глицерина, плотность раствора 1,1 г/см3, 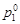 =1,95×105 Па.
=1,95×105 Па.
182. Определить концентрацию раствора сульфата натрия в воде, если при температуре 22 °С давление паров воды над этим раствором 2,61×103 Па, кажущаяся степень диссоциации 95,7 %, 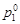 =2,62×103 Па.
=2,62×103 Па.
183. При какой температуре закипит водный раствор хлорида меди (II) концентрацией 2 %, если кажущаяся степень диссоциации 97 %?
184. Найти температуру кипения раствора сульфата натрия в воде, если при 27 °С раствор этой соли имеет осмотическое давление 7,16×105 Па, плотность 1,06 г/см3. Кажущаяся степень диссоциации 96 %.
185. Какой должна быть концентрация раствора хлорида цинка в воде, чтобы этот раствор закипал при температуре 100,52 °С? Соль диссоциирована на 100 %. Выразить концентрацию раствора (плотность 1,04 г/см3) всеми способами.
186. Определить кажущуюся степень диссоциации нитрата натрия, если этот раствор кипит при температуре 100,1 °С, а в 100 г воды растворено 0,85 г соли.
187. Раствор хлорида алюминия в воде концентрацией 0,2 моль/кг кипит при температуре 100,406 °С. Найти осмотическое давление этого раствора при температуре кипения, если его плотность 1,06 г/см3.
188. В 100 г воды содержится 0,58 г хлорида натрия. При какой температуре закипит этот раствор, если кажущаяся степень диссоциации 96 %?
189. Какова кажущаяся степень диссоциации бромида калия в растворе концентрацией 2 %, если он закипает при 100,17 °С.
190. Определить эбуллиоскопическую постоянную этилового спирта, если известно, что раствор, содержащий 0,506 г йодноватой кислоты и 31,8 г этанола, кипит при температуре 78,464 °С. В данных условиях кислота диссоциирована на 32,6 %, а температура кипения чистого этанола 78,3 °С.
191. Вычислить относительное понижение давления водяного пара над раствором хлорида кобальта (II), если при кажущейся степени диссоциации 93 % раствор кипит при температуре 100,30 °С.






