285. Хлорид гидроксомагния + соляная кислота.
Задание IV. Cоставить молекулярные уравнения реакций, которым соответствуют ионно-молекулярные уравнения.
| 286. H+ + OH- ® H2O. | 291. SO32- + 2 H+ ® SO2 + H2O. |
| 287. Pb2+ + S2- ® PbS¯. | 292. Pb2+ + CrO42- ® PbCrO4¯. |
| 288. ClO- + H+ ® HClO. | 293. HCO3- + OH- ® CO32- + H2O. |
| 289. CO32- + 2H+ ® CO2 + H2O. | 294. ZnOH+ + H+ ® Zn2+ + H2O. |
| 290. CH3COOH + OH- ® CH3COO- + H2O. | 295. Mg2+ + CO32- ® MgCO3¯. |
| 296. Cu2+ + S2- ® CuS¯. | 306. HCO3- + H+ ® H2O + CO2. |
| 297. SiO32- + 2 H+ ® H2SiO3. | 307. Cu2+ + 2OH- ® Cu(OH)2¯. |
| 298. CaCO3 + 2H+ ® Ca2+ + H2O. | 308. Pb2+ + 2 I- ® PbI2¯. |
| 299. Al(OH)3 + OH- ® [Al(OH)4]-. | 309. Sr2+ + SO42- ® SrSO4¯. |
| 300. Pb2+ + 2 I- ® PbI2¯. | 310. Sr2+ + CO32- ® SrCO3¯. |
| 301. Fe(OH)3 + 3H+ ® Fe3+ + 3H2O. | 311. 2Ag+ + SO42- ® Ag2SO4¯. |
| 302. Cd2+ + 2OH- ® Cd(OH)2¯. | 312. Ba2+ + CO32- ® BaCO3¯. |
| 303. H+ + NO2- ® HNO2. | 313. Cd2+ + 2 OH- ® Cd(OH)2¯. |
| 304. Zn2+ + H2S ® ZnS¯ + 2 H+. | 314. CuOH+ + H+® Cu2+ + H2O. |
| 305. Ag+ + Cl- ® AgCl¯. | 315. NH4+ + OH- ® NH4OH. |
Задание V. Закончить и уравнять реакцию.
| 316. AgNO3 + H2S ® … | 340. CdCl2 + H2S ® … |
| 317. AgNO3 + K2Cr2O7 ® … | 341. CH3COOAg + H2S ® … |
| 318. AgNO3 + K2CrO4 ® … | 342. CH3COOH + Ba(OH)2 ®... |
| 319. Al(OH)3 + H2SO4 ® … | 343. CH3COOH + NH4OH ® |
| 320. Al2(SO4)3 + AgNO3 ® … | 344. CH3COOK + H2SO4 ® … |
| 321. AlBr3 + AgNO3 ® … | 345. HCOOK + H2SO4 ® … |
| 322. AlI3 + AgNO3 ® … | 346. CH3COOPb + Na2CrO4 ® … |
| 323. Ba(NO3)2 + Cr2(SO4)3 ® … | 347. CH3COOPb + Na2SO4 ® … |
| 324. Ba(NO3)2 + K2CrO4 ® … | 348. Cr2(SO4)3 + NaOH ® … |
| 325. Ba(NO3)2 + Na2SO4 ® … | 349. Cr2(SO4)3 + NH4OH ® … |
| 326. Ba(OH)2 + CO2 ® … | 350. Cu(NO3)2 + Ba(OH)2 ® … |
| 327. BaCl2 + Al2(SO4)3 ®... | 351. Cu(NO3)2 + H2S ® … |
| 328. BaCl2 + Na3PO4 ® … | 352. Cu(NO3)2 + Na2S ® … |
| 329. BaCl2 + CH3COOAg ®... | 353. CuSO4 + NaOH ® … |
| 330. Bi(OH)(NO3)2 + HNO3 ® … | 354. CuSO4 + NH4OH ® … |
| 331. Ca(NO3)2 + H2C2O4 ® … | 355. CuSO4 + Ba(OH)2 ® … |
| 332. Ca(NO3)2 + Na2SO4 ® … | 356. Fe(OH)3 + H2SO4 ® … |
| 333. Ca(NO3)2 + Na3PO4 ® … | 357. Fe2(SO4)3 + NaOH ® … |
| 334. Ca(OH)2 + CO2 ® … | 358. FeCl3 + KOH ® … |
| 335. CaCl2 + H2SO4 ® … | 359. FeOHCl2 + HCl ®... |
| 336. CaCO3 + CH3COOH ® … | 360. FeS + HCl ® … |
| 337. CaCO3 + HCl ® … | 361. H2S + NH4OH ®... |
| 338. CaCO3 + CO2 + H2O ®... | 362. HCOOK + HNO3 ®... |
| 339. Cd(NO3)2 + Na2S ® … | 363. HF + KOH ® … |
| 364. Hg(NO3)2 + H2S ®... | 385. Na2HPO4 + NaOH ® … |
| 365. HNO2 + NH4OH ® … | 386. NaHSO4 + NaOH ® … |
| 366. K2CO3 + H3PO4 ® … | 387. NaHSO4 + Ba(NO3)2 ®... |
| 367. K2CO3 + HCl ® … | 388. NaOH + H2SO3 ® … |
| 368. KHSO3 + H2SO4 ®... | 389. NaOH + H2SO4 ® … |
| 369. KOH + HCN ® … | 390. NH4Cl + Ca(OH)2 ®... |
| 370. KOH + H3PO4 ® … | 391. NH4Cl + NaOH ® … |
| 371. Mg(NO3)2 + (NH4)2C2O4 ®... | 392. NH4Cl + Sr(OH)2 ® … |
| 372. MgCO3 + HCl ® … | 393. NH4Cl + Ba(OH)2 ® … |
| 373. MgOHCl + HCl ®. | 394. Ni(NO3)2 + KOH ® … |
| 374. MnCl2 + NH4OH ® … | 395. NiSO4 + (NH4)2S ® … |
| 375. Na2S + H2SO4 ® … | 396. Pb(NO3)2 + Fe2(SO4)3 ® … |
| 376. Na2S + NiSO4 ® … | 397. Pb(NO3)2 + K2CrO4 ® … |
| 377. Na2S + CdSO4 ® … | 398. Pb(NO3)2 + KI ® … |
| 378. Na2SiO3 + H2SO4 ® … | 399. Pb(NO3)2 + Na2S ®... |
| 379. Na2SO4 + BaCl2 ® … | 400. Pb(NO3)2 + NaCl ® … |
| 380. Na2SO4 + H2SO4 ® … | 401. Sr(NO3)2 + H2SO4 ®... |
| 381. Na2SO4 + Pb(NO3)2 ®... | 402. Zn(NO3)2 + KOH ® … |
| 382. Na2SO4 + BaCl2 ® … | 403. Zn(OH)2 + H2SO4 ® … |
| 383. NaHCO3 + HCl ® … | 404. Zn(OH)2 + NaOH(избыток) ®... |
| 384. NaHCO3 + NaOH ®... | 405. Zn(OH)2 + NaOH ® … |
2. Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И.Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms. Определенные значения трех квантовых чисел (n, l,ml) описывают состояние электрона, называемое атомной орбиталью (АО).
Главное квантовое число n определяет энергию АО и номер энергетического уровня, на котором находится электрон, и может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число l определяет форму АО и энергетический подуровень, оно может принимать значения от нуля до n -1. Исторически атомным орбиталям со значениями l, равным 0, 1, 2, 3 присвоены буквенные обозначения s -, p -, d -, f -. В графических схемах электронного строения атомов каждая орбиталь обозначается символом.
 Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от – l до + l.
Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от – l до + l.
Спиновое квантовое число m s характеризует собственный момент импульса и связанный с ним магнитный момент и может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений l и n выражается электронными или электронно-графическими формулами.
При заполнении АО действует принцип Паули, из которого следует, что в атоме не может быть двух электронов, характеризующихся одинаковым набором значений четырех квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому электроны в основном состоянии в атоме располагаются так, чтобы модуль суммарного спина всех электронов подуровня был максимальным. Например, четыре валентных p -электрона атома кислорода размещаются в квантовых ячейках следующим образом:
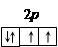

Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого: порядок заполнения определяется возрастанием суммы n + l, а при одинаковом ее значении первым заполняется подуровень с меньшим значением n в этой сумме. Например,
1 s ®2 s ®2 p ®3 s ®3 p ®4 s ®3 d ®4 p ®5 s ®4 d ®5 p ®6 s ®5 d 1(La)®4 f
(лантаноиды)®5 d ®6 p ®7 s ®6 d 1(Ac)®5 f (актиноиды)®6 d ®…
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s -элементы – заполнение внешнего s -подуровня (например, литий 1 s 2 2 s 1), р -элементы – заполнение внешнего p -подуровня (например, фтор – 1 s 22 s 2 2 p 5), d -элементы – заполнение предвнешнего d -подуровня (например, ванадий – 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 3), f -элементы – заполнение f -подуровня второго снаружи уровня (например,  неодим – 1 s 2 2 s 2 2 p 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 4).
неодим – 1 s 2 2 s 2 2 p 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 4).
Для d - и f -элементов возможны отклонения от описанного способа заполнения АО – так называемый провал электрона. Это явление связано с тем, что для атома устойчивым состоянием является полностью или наполовину заполненная АО, т.е. d 10, d 5, f 14, f 7. В ситуации, когда до достижения такого состояния не хватает одного электрона, он переходит («проваливается») с предыдущего уровня. Например, электронный паспорт серебра 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 9 с учетом провала электрона примет вид 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 14 d 10.
Если на валентных энергетических уровнях имеются вакантные АО, то при получении электронами порции энергии (возбуждении атома) становится возможным «разъединение» валентных электронов, т.е. их переходы с тех подуровней, где все АО заняты полностью (¯) или частично (), на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбужденных состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
Пример 1. Составить электронную формулу атома брома и графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях.
Решение. 1. Порядковый номер брома – 35, следовательно атом брома имеет 35 электронов. Бром находится в IV периоде периодической системы, следовательно, АО с n, равным 1; 2 и 3 заполнены полностью. Бром относится к p -элементам, следовательно, заполнен 4 s -подуровень. В ряду 4 p -элементов бром – пятый элемент, следовательно, на 4 p -подуровне – пять электронов. Таким образом, электронная формула брома имеет вид 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 5.
2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т.е. 4 s -, 4 p - и незаполненные 4 d -орбитали. Графически схема заполнения электронами этих орбиталей имеет вид
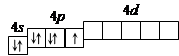 |

в таком состоянии бром имеет валентность 1, которой соответствуют степени окисления -1 и +1.
3. При затрате некоторой энергии спаренный p -электрон перейдет на свободную d -орбиталь. В этом первом возбужденном состоянии
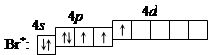 |

бром имеет валентность 3, которой соответствует степень окисления +3.
4. При передаче атому брома еще некоторого количества энергии следующий p -электрон также перейдет на свободную d -орбиталь. Во втором возбужденном состоянии
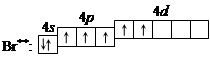 |

бром имеет валентность 5, которой соответствует степень окисления +5.
5. При передаче атому брома еще некоторого количества энергии s -электрон также перейдет на свободную d -орбиталь. В третьем возбужденном состоянии
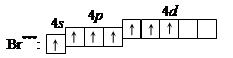 |

бром имеет валентность 7, которой соответствует степень окисления +7.
Пример 2. Составить электронные формулы атома селена в состояниях Se-2 и Se+4 и графические схемы заполнения электронами валентных орбиталей.
Решение. 1. Cоставим электронную формулу атома селена (см. пример 1): 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 4. Графическая схема заполнения электронами валентных орбиталей имеет вид
 |


2. Для получения Se-2 необходимо к атому селена добавить два электрона на 4 p -орбиталь (согласно правилу Клечковского). Тогда графическая схема примет вид
 |

Электронная формула Se-2 – 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 6.
3. Для получения Se+4 необходимо убрать четыре электрона с 4 p -орбитали, атома селена:
 |

Электронная формула Se+4 – 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 0.
Пример 3. Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3 d 6, определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
Решение. Согласно правилу Клечковского 3 d -элементы находятся в четвертом периоде таблицы Д.И.Менделеева. На данной орбитали находится шесть электронов, значит, это шестой по счету среди 3 d -элементов, т.е. железо, полная электронная формула которого 1 s 22 s 22 p 63 s 23 p 64 s 23 d 6.
Задание I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
| 1. B, Al, Th. 2. Po, Ba, Lu. 3. Mg, Pm, Be. 4. Br, Co, Hf. 5. C, Tm, As. 6. Nd, Ca, V. 7. Ta, O, Ce. 8. Y, Rb, S. | 9. At, Xe, Lr. 10. Cs, U, H. 11. Cl, Cu, Bi. 12. Na, Ac, Fe. 13. Pb, Ra, Dy. 14. Ag, Re, In. 15. Cd, K, Pa. 16. P, Se, Li. | 17. Yb, Mn, Sn. 18. Mo, La, N. 19. Pu, Ni, Sb. 20. Au, Np, Rn. 21. Cr, Tl, Cm. 22. Si, I, Zr. 23. Tb, Sr, Bk. 24. Fr, Ti, W. | 25. He, Hg, Gd. 26. Pt, Ne, Sm. 27. Ga, Ru, Ho. 28. Sc, Pr, Os. 29. Ar, Ir, Eu. 30. Zn, Rh, Er. 31. Kr, Pd, Am. 32. Ge, Cf, F. |
Задание II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
| 33. Li+, C+2. 34. O-2, F-. 35. Na+, N-3. 36. Ca+2, C+4. 37. Al+3, B-3. 38. C-4, Ba+2. 39. S+6, P-3. 40. P+5, Cl-1. | 41. I+5, Fe+3. 42. Be+2, Co+3. 43. Cr+6, Cu+2. 44. I-, P+3. 45. Cr+3, Br+3. 46. Ag+, Sn+4. 47. Zn+2, S-2. 48. K+, Fe+2. | 49. Zr+4, Pb+2. 50. N+5, Br-. 51. Ni+2, Cl+5. 52. Se-2, Cs+. 53. Te-2, Sr+2. 54. Bi+3, Si-4. 55. B+3, Sc+2. 56. Mg+2, Mn+7. | 57. Cd+2, Sn+2. 58. Nb+3, Hg+. 59. Tl+, V+3. 60. Ti+4, Mn+2. 61. Os+3, Au+3. 62. Rb+, Ce+3. 63. Fr+1, Y+3. 64. H+, Re+7. |
Задание III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
| 65. 4 d 1. 66. 3 d 10. 67. 4 s 13 d 10. 68. 5 d 2. 69. 6 p 2. 70. 6 s 14 f 145 d 10. 71. 4 s 23 d 5. 72. 4 s 13 d 5. | 73. 7 s 26 d 1. 74. 5 d 3. 75. 6s24 f 2. 76. 6 p 1. 77. 5 s 14 d 5. 78. 4 f 3. 79. 6 d 15 f 3. 80. 5 s 24 d 5. | 81. 5 d 8. 82. 5 s 14 d 10. 83. 5 s 24 d 10. 84. 5 s 2. 85. 5 p 3. 86. 6 p 4. 87. 4 d 6. 88. 5 d 6. | 89. 5 f 7. 90. 5 d 6. 91. 5 f 2. 92. 4 d 7. 93. 5 d 14 f 7. 94. 4 f 10. 95. 4 d 8. 96. 5 p 6. |
3. Основные понятия и законы химии
Моль, молярная масса. Известно, что любое вещество состоит из атомов, химические процессы протекают благодаря взаимодействию атомов. Из практических соображений было введено понятие моля. Условились считать, что 1 моль вещества содержит 6,02×1023 частиц, любых – атомов, молекул, ионов. Число 6,02×1023 называется числом Авогадро. Математически понятие моля можно записать в виде формулы
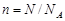 ,
,
где n – количество вещества, моль; N – число частиц (молекул, атомов, ионов); N A – число Авогадро.
Массу 1 моль вещества называют молярной массой M. Молярная масса в неорганической химии является характеристикой вещества, непосредственно связанной с его количественным составом и численно равна молекулярной массе (массе одной молекулы) вещества, выраженной в углеродных единицах. Молярная масса любого вещества
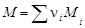 ,
,
где n i – стехиометрический индекс в формуле вещества; Мi – молярная масса элемента, входящего в соединение, г/моль (см. таблицу элементов Д.И.Менделеева).
Масса и количество вещества связаны зависимостью
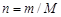 .
.
Молярная масса вещества может быть определена экспериментально. Для газов ее находят, например, по относительной плотности газа D, которая представляет собой соотношение молярных масс двух газов, одна из которых обычно известна:
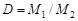 .
.
Наиболее часто используют плотность газа по воздуху D возд, тогда М 2 = М возд D возд (М возд = 29 г/моль), или по водороду 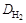 , тогда М 2 =
, тогда М 2 = 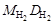 .
.
Основные газовые законы. Состояние газа характеризуется его температурой, давлением и объемом. Если температура газа 0 °С (273,15 K), а давление 1 атм (1,013×105 Па = 760 мм рт. ст.), то условия, при которых находится газ, называют нормальными.
Взаимосвязь между объемом и количеством вещества газа описывается законом Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется молярным объемом газа VM. При нормальных условиях VM = 22,4 л и количество вещества газа в молях может быть вычислено по уравнению
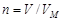 .
.
Взаимосвязь между количеством вещества, температурой, давлением и объемом газа устанавливает уравнение Менделеева – Клапейрона:
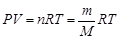 ,
,
где P – давление, Па; V – объем, м3; n – количество вещества, моль; m – масса, г; М – молярная масса газа, г/моль; R – универсальная газовая постоянная, в системе СИ R = 8,314 Дж/(моль×K).
На практике чаще всего приходится иметь дело со смесью газов. Каждый газ вносит свой вклад в общее давление системы – парциальное давление. Парциальным называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Парциальное давление может быть вычислено через объемное содержание газа в газовой смеси или через мольную долю газа. Соответственно
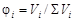 ;
; 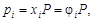
где Vi – объем данного газа; S Vi – общий объем газовой смеси; ni – количество вещества данного газа; S ni – сумма числа молей всех компонентов газовой смеси; xi – мольная доля газа, 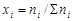 ; P – общее давление смеси газов.
; P – общее давление смеси газов.




