Топливом называют естественные и искусственные вещества, которые технически целесообразно и экономически выгодно сжигать для получения тепловой энергии. По происхождению различают природные и искусственные топлива, по агрегатному состоянию - твердые, жидкие и газообразные. К твердым топливам относят торф, бурый уголь, каменный уголь, антрацит, дрова и сланцы. В качестве жидкого топлива используют бензин, керосин, дизельное топливо, мазут, т. е. продукты переработки нефти. Природный газ может находиться в залежах трех типов: газовых, газонефтяных и газоконденсатных. К искусственным газам относят газы, которые образуются при переработке других видов топлива или при их сжигании, например, генераторный, коксовый, подземной газификации, доменный и др.
Органическая часть топлив состоит из большого количества сложных химических соединений, в состав которых входят: углерод (С), водород (Н), сера (S), кислород (О) и азот (N). Кроме того, топливо содержит минеральные примеси - золу (А) и влагу (W). Для характеристики топлива пользуются элементарным его составом, который отражает процентное содержание отдельных элементов в 1 кг твердого и жидкого топлива или в 1 м3 газообразного топлива.
Различают три основные так называемые массы топлива:
• рабочую, характеризующую состав топлива в том виде, в каком оно сжигается.
CP + HP + SP + OP + NP + AP + WP = 100%;
• сухую, освобожденную от влаги
CС + HС + SС + OС + NС + AС = 100%;
• горючую, освобожденную от золы и влаги,
CГ + HГ + SГ + OГ + NГ = 100%;
Горючая масса дает наиболее правильное суждение о топливе как о горючем. Однако все тепловые расчеты ведутся по рабочей
массе топлива. Поэтому для пересчета элементарного состава топлива служат соотношения:

|

|
• из горючей в рабочую массу
• из сухой в рабочую массу
Таким образом, влажность и зольность топлива являются балластом, снижающим его качество. Кислород, находящийся в топливе, вступает в соединение с горючими компонентами, окисляет их и снижает тепловую ценность топлива. Азот - элемент инертный, но при определенных условиях может образовывать окислы. Эта реакция протекает с поглощением теплоты, что снижает эффективность использования топлива. Кроме того, эти окислы оказывают вредное воздействие на окружающую среду и здоровье людей.
Основной характеристикой топлива, определяющей его энергетическую ценность, является теплота сгорания. Различают теплоту сгорания высшую и низшую, удельную и объемную. Высшей теплотой сгорания QРВ называется количество теплоты, которое выделяется при полном сгорании единицы топлива при условии охлаждения продуктов горения до температуры конденсации образовавшихся паров воды. Низшей теплотой сгорания QРН называется количество теплоты, которое выделяется при полном сгорании топлива, но без учета теплоты конденсации водяных паров.

|
| где G - удельная масса воды в продуктах горения; r - скрытая теплота парообразования, r = 600 ккал/кг влаги. |

|
Тогда
Следовательно

Высшую теплоту сгорания определяют в результате лабораторных испытаний топлива. Низшую теплоту сгорания топлива можно определить расчетным путем по его элементарному составу. Для твердого и жидкого топлива используют формулу Д. И. Менделеева.
QРН = 81СР + 246НP + 26(SP – ОP) – 6W, ккал/кг топлива, QРН = 4,1868 QРН, кДж / кг топлива.
Теплота сгорания сухого газового топлива определяется следующим образом:
Q = 30,2CO + 25,7Н2 + 85,5СН4+141С2Н4 + 152 С2Н6 +
+ 56H2S + 218С3Н8 + 283С4Н10, кДж/кг топлива,
Q = 4,1868 Q, кДж/м3 сухого газа, :
где CP, HP, SP, OP, WP - составляющие рабочей массы твердого и жидкого топлива, %;
СО, Н2, СН4, С2Н4 и т. д. - составляющие сухого газообразного топлива, %.
Коэффициенты при этих составляющих представляют собой количество теплоты, выделяющееся при сжигании 1 кг углерода или других компонентов топлива.
Для учета расхода топлива разных марок или видов в Российской Федерации введено понятие условного топлива, теплота сгорания которого равна 29 330 кДж/кг у.т. или 7 000 ккал/кг у.т. При пересчете расхода натурального топлива ВН в условное ВУ пользу-ются калорийным эквивалентом КЭ = QРН / 7000 (29330), на который умножают расход натурального топлива, т. е.
ВУ = ВН ∙ КЭ
Если использовалось несколько видов топлива ВHi, с различной теплотой сгорания QРНii, тогда расход условного топлива составит, кг у. т.,

2.3. Характеристика процесса горения топлива
Горение есть процесс быстрого химического соединения горючих элементов топлива с окислителем, сопровождающийся интенсивным выделением теплоты. Процесс горения — это сочетание физических (перемешивание топлива с окислителем, подогрев, испарение) и химических процессов (окисление топлива). Для определения количества теплоты, которое выделяется в процессе горения топлива, нужно знать, какие химические реакции протекают при этом, а также количество теплоты, получаемое в каждой реакции. Такие расчеты выполняются на основе закона постоянства сумм теплоты, открытого в 1840 г. русским химиком Г. И. Гессом. Согласно этому закону для определения количества теплоты в результате сгорания топлива достаточно знать начальное состояние системы (состав топлива и окислителя) и ее конечное состояние (состав продуктов сгорания).
Рассмотрим расчетные реакции горения горючих элементов топлива для полного горения:
С + О2 = СО2 + 34МДж/кг.
12 + 32 = 44 [кг] или 1 + 2,67 = 3,67 [кг].
2Н2 + О 2 = 2Н2О + 143 МДж/кг.
4 + 32 = 36 [кг] или 1 + 8 = 9 [кг].
S + O2=SO2 + 9,15 МДж/кг.
32 + 32 = 64 [кг] или 1 + 1 = 2 [кг].
В соответствии с этими соотношениями можно определить массу кислорода LO2 кг, необходимую для полного сгорания топлива:
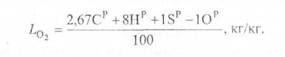
Сухой воздух состоит из азота и кислорода в следующих соотношениях: по массе О2 = 23,2%, N2 = 76,8%, по объему О2 = 21%, N2 = 79%. Тогда для горения I кг топлива необходима масса воздуха;

или

Зная плотность сухого воздуха при нормальных условиях (g=1,293 кг/м3), можно определить его объем, необходимый для сжигания:

|
| • 1 м3 газообразного топлива |

|
• 1 кг твердого или жидкого топлива
Атмосферный воздух всегда содержит некоторое количество влаги, которое необходимо учитывать при расчетах. Объем водяных паров в воздухе, теоретически необходимом для полного сгорания 1 кг (м3) топлива, составляет

где d - влагосодержание воздуха, кг/кг сухого воздуха.
С учетом этого теоретическое количество воздуха при нормальных условиях
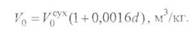
Эксплуатационные условия при сжигании всех видов топлива не позволяют достичь однородной смеси топлива и воздуха, что приводит к химическому недожогу топлива и снижению эффективности работы тошшвоиспользующих установок. Поэтому в топку обычно подается воздуха больше, чем теоретически необходимо. Отношение действительно поступающего в топку количества воздуха (Vд) к теоретическому объему (V0) называют коэффициентом избытка воздуха. Он равен

Коэффициент избытка воздуха зависит от вида топлива, способа его сжигания, конструкции топочного устройства и является важной характеристикой работы топливоиспользующих установок. Так, при сжигании природного газа а г = 1,03... 1,05, мазута а м = 1,1... 1,2, угля а у = 1,2... 1,4.






