Электролизом называют окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. Различают электролиз расплавов и электролиз водных растворов. Электролизводных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекулы воды: 1) восстанавливаться на катоде по схеме 2Н2О + 2 ē ® Н2 + 2ОН–. 2) окисляться на аноде по схеме 2Н2О – 4 ē ® О2 + 4Н+. Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает: 1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала; 2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала. При реализации данных принципов на практике следует вычислить потенциалы всех возможных процессов и сравнить их между собой. На катоде при этом могут возникнуть три случая: 1. Потенциал восстановления катиона Е  больше потенциала восстановления воды Е
больше потенциала восстановления воды Е 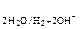 , причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла Mе n + + nē ® Me. 2. Е
, причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла Mе n + + nē ® Me. 2. Е  < Е
< Е  , причем
, причем  В, тогда на катоде идет процесс восстановления молекул воды. 3. Е
В, тогда на катоде идет процесс восстановления молекул воды. 3. Е  » Е
» Е 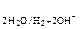 , то есть
, то есть  В, тогда на катоде идут сразу оба восстановительных процесса: Mе n + + 2Н2О + (2 + n) ē ® Me + Н2 + 2ОН–. Для процессов на аноде в первую очередь следует определить тип анода. Если анод растворимый, то тогда независимо от состава электролита будет происходить окисление материала анода. Например, для железного анода Fe – 2 ē ® Fe2+. Если анод инертный, то окислению будет подвергаться одна из частиц электролита (анион или молекула воды). Для реальных процессов окисления на инертном аноде выполняется следующее: 1. В первую очередь на инертных анодах в разбавленных водных растворах окисляются простые анионы в порядке возрастания их стандартных потенциалов, не превышающих +1,5 В, то есть S2–, I–, Br–, Cl–. Вода при этом не окисляется. 2. При электролизе водных растворов, содержащих анионы кислородсодержащих кислот (СО
В, тогда на катоде идут сразу оба восстановительных процесса: Mе n + + 2Н2О + (2 + n) ē ® Me + Н2 + 2ОН–. Для процессов на аноде в первую очередь следует определить тип анода. Если анод растворимый, то тогда независимо от состава электролита будет происходить окисление материала анода. Например, для железного анода Fe – 2 ē ® Fe2+. Если анод инертный, то окислению будет подвергаться одна из частиц электролита (анион или молекула воды). Для реальных процессов окисления на инертном аноде выполняется следующее: 1. В первую очередь на инертных анодах в разбавленных водных растворах окисляются простые анионы в порядке возрастания их стандартных потенциалов, не превышающих +1,5 В, то есть S2–, I–, Br–, Cl–. Вода при этом не окисляется. 2. При электролизе водных растворов, содержащих анионы кислородсодержащих кислот (СО  , NO
, NO  , SO
, SO  и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме 2Н2О – 4 ē ® О2 + 4Н+, а в щелочных растворах – ионы ОН– по схеме4 ОН– – 4 ē ® О2 + 2Н2О.
и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме 2Н2О – 4 ē ® О2 + 4Н+, а в щелочных растворах – ионы ОН– по схеме4 ОН– – 4 ē ® О2 + 2Н2О.

Поиск:
Рекомендуем:
 Почему я выбрал профессую экономиста
Почему я выбрал профессую экономиста
 Почему одни успешнее, чем другие
Почему одни успешнее, чем другие
 Периферийные устройства ЭВМ
Периферийные устройства ЭВМ
 Нейроглия (или проще глия, глиальные клетки)
Нейроглия (или проще глия, глиальные клетки)
Категории:
Катодные и анодные процессы при электролизе водных растворов
|
|
|
|
|
|
|
|
|
|
Дата добавления: 2016-10-06; Мы поможем в написании ваших работ!; просмотров: 1719 | Нарушение авторских прав
Поиск на сайте:
Лучшие изречения:

