Процессы превращения энергии химической реакции в электрическую лежат в основе работы химических источников тока (ХИТ). К ХИТ относятся гальванические элементы, аккумуляторы и топливные элементы. Гальваническим элементом называют устройство для прямого преобразования энергии химической реакции в электрическую, в котором реагенты (окислитель и восстановитель) входят непосредственно в состав элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать, то есть это – ХИТ одноразового действия. Гальванический элемент состоит их двух полуэлементов (окислительно-восстановительных систем), соединенных между собой металлическим проводником. Полуэлемент (иначе электрод) чаще всего представляет собой металл, помещенный в раствор, содержащий ионы, способные восстанавливаться или окисляться. Каждый электрод характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ). СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р 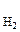 = 1 атм) и раствором, в котором активность ионов водорода а
= 1 атм) и раствором, в котором активность ионов водорода а 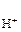 = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением Н+ +
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением Н+ + 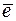 «½ Н2. Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е
«½ Н2. Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е 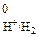 = 0 В). Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид: 1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Ме n + :
= 0 В). Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид: 1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Ме n + : 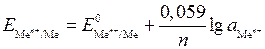 , где Е
, где Е 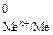 - стандартный электродный потенциал металла, В; а
- стандартный электродный потенциал металла, В; а 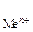 - активность ионов металла в растворе, моль/дм3. Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе. В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией. Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода: D Е = Е катод – Е анод. Поскольку потенциал катода всегда больше потенциала анода, то из формулы следует, что в работающем гальваническом элементе D Е > 0. Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевогомостика – U-образной трубки с раствором электролита.
- активность ионов металла в растворе, моль/дм3. Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе. В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией. Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода: D Е = Е катод – Е анод. Поскольку потенциал катода всегда больше потенциала анода, то из формулы следует, что в работающем гальваническом элементе D Е > 0. Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевогомостика – U-образной трубки с раствором электролита.

Поиск:
Рекомендуем:
 Почему я выбрал профессую экономиста
Почему я выбрал профессую экономиста
 Почему одни успешнее, чем другие
Почему одни успешнее, чем другие
 Периферийные устройства ЭВМ
Периферийные устройства ЭВМ
 Нейроглия (или проще глия, глиальные клетки)
Нейроглия (или проще глия, глиальные клетки)
Категории:
Гальванические элементы. ЭДС гальванического элемента
|
|
|
|
|
|
|
|
|
|
Дата добавления: 2016-10-06; Мы поможем в написании ваших работ!; просмотров: 656 | Нарушение авторских прав
Поиск на сайте:
Лучшие изречения:

