1. Азотная кислота (HNO3) — сильная одноосновная кислота. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах практически полностью диссоциирует на ионы.

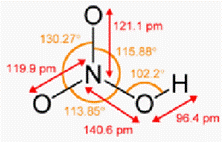
Рис.1П Молекула азотной кислоты
Молярная масса Mr= 63.012 г/моль, жидкость при н.у. с плотностью ρ=1.513 г/см3. Температура плавления Тпл= -41.59ºС, температура кипения Ткип=82.6 ºС. Дипольный момент 2.17±0.02 Дебай.
2. Аммиак (NH3)– при н.у. бесцветный газ с резким запахом (нашатырного спирта), почти вдвое легче воздуха. Растворимость NH3 в воде чрезвычайно велика – около 1200 объемов (при 0 ºС) в объеме воды.


Рис.2П Молекула аммиака
Mr = 17.0306 г/моль. Тпл=-77.73 ºС, Ткип=-33.34 ºС.
История. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, быстро разлагается. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
3. Вода (Н2O) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях. Является хорошим сильнополярным растворителем. Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.


Рис.3П Молекула воды
Mr= 18.01528 г/моль, плотность ρ =0.9982 г/см3, Тпл=0 ºС, Ткип=99.974 ºС
- В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане.
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
- Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C.
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».
- Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают висмут, галлий, свинец и некоторые соединения и смеси).
4. Оксид углерода (II) (угарный газ, окись углерода, монооксид углерода) (CO) — бесцветный ядовитый газ без вкуса и запаха. Молекула CO имеет тройную связь, как и молекула азота N2. Благодаря наличию тройной связи молекула CO весьма прочна и имеет малое межъядерное расстояние (dC≡O =0,1128 нм или 1.13Å). Mr= 28.0101 г/моль, ρ =0.00125 г/см3 (при 0 0С), Тпл= -205 ºС, Ткип= -191.5 ºС.


Рис. 4П Молекула оксида углерода II
Осторожно: Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота; в тяжёлых случаях судороги, потеря сознания, кома. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее и в 200—300 раз быстрее, чем кислород, блокируя процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа.
Интересно: Опытами на молодых крысах выяснено, что 0,02 % концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
5. Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) (CO2) - бесцветный газ, без запаха, со слегка кисловатым вкусом. Mr= 44.0095 г/моль, плотность ρ =0.0019769 г/см3 (при н.у.), Тпл= -57 ºС, Ткип= -78 ºС.


Рис. 5П Молекула оксида углерода IV
При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
6. Серная кислота (H2SO4) — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. Mr= 98.082 г/моль, плотность ρ =1.8356 г/см3, Тпл= -10.38 ºС, Ткип= 279.6 ºС.


Рис. 6П молекула серной кислоты
Серная кислота очень едкое вещество. Оно поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная), смертельная 0,18 мг/л (60 мин). Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, вулканов, содержащих оксиды S, и выпадать в виде кислотных дождей.
7. Сероводород (сернистый водород, сульфид водорода) (H2S) — бесцветный газ с запахом тухлых яиц и сладковатым вкусом. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5— 45 % сероводорода. Mr= 34.082 г/моль, плотность ρ =1.5206 г/см3, Тпл= -82.30 ºС, Ткип= -60.28 ºС.


Рис. 7П Молекула сероводорода
Осторожно: Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться.
8. Фтороводород (фтористый водород, гидрофторид, фторид водорода) (HF) — бесцветный газ с резким запахом. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Mr= 20.01 г/моль, плотность ρ =0.99 г/см3, Тпл= -83.4 ºС, Ткип= 19.54 ºС.


Рис. 8П Молекула фтороводорода
Осторожно: Очень ядовит. Фтористый водород дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей.
Интересно: писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.






