Межклеточное вещество (м.в.) состоит из основного вещества и содержащемся в нем волокон (коллагеновых, эластических, ретикулиновых). Структуры м.в. построены из молекул, вырабатываемых и секретируемых клетками. В свою очередь, компоненты внеклеточного матрикса влияют на клетку (e.g., контролируют пролиферацию и дифференцировку).
I. Соединительная ткань (с.т.) обеспечивает поддержание целостности других тканей, формирует строму органов, содержит кровеносные и лимфатические сосуды, участвует в трофическом обеспечении всех тканей и органов. Среди с.т. выделяют волокнистые ткани (рыхлые и плотные), хрящевую, костную, кровь и лимфу и ткани со специальными свойствами (жировая, ретикулярная, мезенхима).
Внеклеточный матрикс.
В состав всех волокнистых соединительных тканей входит значительный объем м.в. Химический состав, структура и объем внеклеточного матрикса (в.м.) определяют физические свойства каждого типа соединительной ткани. В.м. состоит из основного вещества и погруженных в него волокон различного типа
Основное вещество― аморфный материал со свойствами геля. Тканевая жидкость связывается с компонентами основного вещества, формируя среду для прохождения молекул через соединительную ткань и для обмена веществ с кровью. Основное вещество содержит гликозаминогликаны, протеогликаны и гликопротеины. Молекулы основного вещества прочно связаны с волокнами в.м. и взаимодействуют с различными клетками.
1. Гликозаминогликаны (г.) ― полисахариды, построенные из повторяющихся дисахаридных единиц, одна из которых ― обычно уроновая кислота, а другая М аминосахар (N-ацетилгликозамин, N-ацетилгалактозамин). Г. ―кислые (отрицательно заряженные) соединения, т.к. в их дисахаридных единицах много гидроксильных, карбоксильных и сульфатных групп. Молекулы этих г. гидрофильны, связывают большое количество молекул воды и ионов (в частности, Na 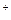 ), входящих во внеклеточную жидкость. Связанные между собой крупные молекулы г. образуют гель, через который диффундирует метаболиты. Известны следующие разновидности г.: гиалуроновая кислота, хондроитинсульфат, дерматансульфар, кератансульфан, гепарансульфат и гепарин (гепаринсунсульфат).
), входящих во внеклеточную жидкость. Связанные между собой крупные молекулы г. образуют гель, через который диффундирует метаболиты. Известны следующие разновидности г.: гиалуроновая кислота, хондроитинсульфат, дерматансульфар, кератансульфан, гепарансульфат и гепарин (гепаринсунсульфат).
2. Протеогликаны (п.) ― волокнистый центральный белок с ковалентно присоединеннымик нему г. Образуются крупные макро молекулы, содержащие 90-95% углеводов. П. могут нековалентно связываться с цепями гиалуроновой кислоты, формируя еще более крупные комплексы (e.g., п. хряща).
3. Гликопротеины состоят из полипептидных цепей, соединенных с разветвленными полисахаридами, и связывают клетки с в.м. Различают гликопротеины, формирующие волокнистые структуры (фибронктин и фибриллин), а также ряд неволокнистых белков (ламинин, тенасцин и энтактин). Фибронектин найден в базальной мембране, вокруг коллагеновых молекул и клеток. Большое количество находится в плазме крови. Он участвует в адгезии клеток, связывая их с компонентами внеклеточного матрикса (коллагеном и гликозаминогликанами). Рецептор ― интегрин, встроенный в клеточную мембрану. Внутри клетки интегрин взаимодействует с актиновыми микрофиламентами субмембранного цитоскелета, а снаружи соединяется с фибронектином. В свою очередь, фибриноген образует связи с коллагеном и гликозаминогликанами. Так устанавливается структурная непрерывность между цитоскелетом и вне4леточным матриксом. Фибриллин (М 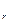 ≈ 350 кД) формируем микрофибриллы диаметром 8-12 мкм, усиливая связи между внеклеточными компонентами: входит в состав эластических волокон, обеспечивая их упорядоченное строение. Мутации гена фибриллина приводят к развитию синдрома Морфана.
≈ 350 кД) формируем микрофибриллы диаметром 8-12 мкм, усиливая связи между внеклеточными компонентами: входит в состав эластических волокон, обеспечивая их упорядоченное строение. Мутации гена фибриллина приводят к развитию синдрома Морфана.
Волокна.
Во внеклеточном матриксе погружены различные типы волокон: построенные из коллагенов коллагеновые и ретикулиновые волокна и эластические волокна (в их состав входит эластин и фибриллин).
Коллагеновые волокна ― главный компонент большинства соединительных тканей, а коллаген ― наиболее распространенный белок.
Молекула коллагена (к.) ― спираль из трех про-α-цепей. Длина подобной спирали ― 300 нм, диаметр ― 1,5 нм. Все типы к. содержат области с повторяющейся последовательностью из трех аминокислот с глицерином в третьем положении.1-ая аминокислота в такой последовательности может быть любая, 2-ая ― пролин, гидроксипролин или лизин. Благодаря обилию поперечных связей между остатками лизина, коллагеновые волокна обладают высокой прочностью. Известно не менее 13 типов к. Наиболее распространены коллагены первых пяти типов, остальные встречаются сравнительно редко и в небольших количествах. К. I, II и III образуют фибриллы с периодичностью 65 нм. К. типа I ― один из наиболее распространенных, синтезируется фибробластами, остеобластами, гладкомышечными клетками. К. II синтезируется фибробластами, хондроцитами, нейронами сетчатки, присутствует в стекловидном теле. К. типа III входит в состав ретикулиновых волокон, образующих нежную сеть в некоторых органах и тканях, синтезируется фибробластами и ГМК. К. типа IV образует сетевидную основу базальных мембран, синтезируется большинством эпителиальных клеток. К. типа V присутствует в кровеносных сосудах, вокруг ГМК и в костном матриксе, синтезируется ГМК и остеобластами.
Образование коллегановых волокон ― на внутриклеточном этапе в гранулярной эндоплазматической сети происходит синтез и сборка про-α-цепей. Далее в цистернах комплекса Гольджи осуществляется гидроксилирование и гликозилирование полипептидов, в результате образуются спирали из трех про-α-цепей (проколлаген). Каждая про-α-цепь содержит концевые участки ― регистрационные пептиды. Эти пептиды предотвращают внутриклеточное объединение спиралей проколлагена в коллагеновые фибриллы. Молекулы проколлагена накапливаются в секреторных гранулах и выделяются в о внеклеточное пространство. Вне клетки регистрационные пептиды молекулы проколлагена отщепляются при помощи проколлагеновой пептидазы (образующуюся молекулу называют тропоколлагеном). Это отщепление не происходит у коллагенов типов IV и V, чем и объясняется отсутствие фибрилл, построенных из к. этих типов. Далее происходит сборка коллагеновых фибрилл. Молекулы тропоколлагена имеют хвостовой и головной концы и спонтанно объединяются в параллельно расположенные цепи, выстраиваясь последовательно: «конец в конец» и «сторона к стороне». При этом между головными и хвостовыми концами остаются зазоры шириной 35нм. Каждая молекула тропоколлагена в цепи смещена относительно молекулы в соседней цепи на четверть её длины, что и служит причиной чередования темных и светлых полос с периодичностью 65 нм. Более толстые фибриллы образуются путем присоединения новых молекул тропоколлагена. В формировании поперечных связей между молекулами тропоколлагена участвует медьсодержащий фермент лизилоксидаза. Взаимодействие коллагена с гликозаминогликанами и фибронектином регулирует сборку фибрилл. Коллагеновое волокно формируется из многих параллельно связанных гликопротеинами коллагеновых фибрилл. Пучки коллагеновых волокон ― погруженная в межклеточный матрикс совокупность коллагеновых волокон.
Эластические волокна (э.в.). Эластические структуры (волокна и мембраны) обладают выраженными эластическими свойствами. Э.в. присутствуют в эластическом хряще, коже, легких, кровеносных сосудах. Окончатые эластические мембраны характерны для крупных артерий. Эластическое волокно (ветвящаяся нить диаметром 0,2-1,0 мкм) состоит из фибриллина и аморфного эластина. Гликопротеин эластин, как и коллаген, содержит много глицина и пролина. Фибробласты и ГМК синтезируют эластин и Фибриллин цистернах гранулярной эндоплазматической сети. В комплексе Гольджи происходит упаковка полипептидов в секреторные гранулы, выделяемые во внеклеточную среду. При образовании эластина три альдегидные группы взаимодействуют с одной аминогруппой лизина, образуя десмозин и изодесмозин. Лизилоксидаза путем окислительного дезаминирования ε-аминогруппы в остатках лизина обеспечивает формирование межмолекулярных связей между молекулами эластина. В результате появляется упругая резиноподобная сеть молекул, способная после деформации восстанавливать исходную форму. Эта сеть и составляет основу эластических структур. Микрофибриллы фибриллина образуются ещё до сборки эластина. После формирования каркаса из фибриллина эластин организуются в волокно, причем микрофибриллы оказываются как внутри, так и снаружи волокна.
Ретикулиновые волокна ― тонкие нити диаметром 0,5-2,0 мкм, состоящие из к. типа III, связанного из гликопротеинами и протеогликанами.
Базальная мембрана ― особый вид внеклеточного матрикса, имеет вид листа или пластинки толщиной 20-200 нм. И состоит из специальных белков различного типа.
Соединительная ткань:
1. Рыхлая с.т. содержится во всех органах, образуют строму, сопровождает сосуды. Содержит хаотично распределенные коллагеновые и эластические волокна. Между волокнами находится основное вещество. Молекулы гликозаминогликанов, переплетаясь, образуют сеть в ячейках и каналах которых удерживается большое количество тканевой жидкости с растворенными в ней веществами.
2. Плотная с.т. содержит большое количество плотно расположенных молекул, количество основного вещества незначительно.
а) плотная неоформленная с.т. ― большое количество плотно, но беспорядочно расположенных волокон (собственно кожа);
б) плотная оформленная с.т. ― волокна расположены плотно, образуя параллельно идущие пучки (связки, сухожилия, фиброзные мембраны).
Эластичная связка ― эластин, формирующий толстые волокна. Между ними расположены тонкие коллагеновые волокна и фиброциты.
Сухожилие ― коллагеновые волокна, формирующие сухожильные пучки I, II и III порядка. Пучки I порядка, окруженные рыхлой с.т. с сосудами и нервами, образуют пучки II порядка, несколько пучков II порядка объединены рыхлой с.т. в пучки III порядка.
Фиброзные мембраны ― пучки коллагеновых волокон и лежащие между ними фиброциты расположены слоями. В каждом слое волнообразные пучки коллагеновых волокон проходят параллельно в одном направлении, отличном от направлений в соседних слоях. Отдельные пучки волокон переходят из одного слоя в другой, связывая их между собой (фасции, сухожильный центр диафрагмы, капсулы внутренних органов).
3. Хрящевая ткань: м.в. является хрящевой матрикс (х.м.). Х.м. содержит до 75% воды, что позволяет веществам из сосудов надхрящницы диффундировать в матриксе и осуществлять питание хондроцитов. Важное значение для обеспечения прочности и упругости хряща имеют белки хрящевого матрикса. Функционально наиболее значимы коллагены, протеогликаны и хондронектин.
Коллагены: тип II, образующий коллагеновые волокна, составляет до 40% сухого веса хряща. Тип IV сшивает коллагеновые волокна. Его содержание в хряще в пять раз меньше, чем коллагена типа II. α 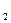 -цепь этого коллагена ковалентно связывает хондроитинсульфат. Тип VI найден в матриксе гиалинового и эластического хряща, а также в n. pulposus межпозвоночного диска. Тип X ― редкая форма коллагена, с ним связывают способность некоторых хрящей к обызвествлению.
-цепь этого коллагена ковалентно связывает хондроитинсульфат. Тип VI найден в матриксе гиалинового и эластического хряща, а также в n. pulposus межпозвоночного диска. Тип X ― редкая форма коллагена, с ним связывают способность некоторых хрящей к обызвествлению.
Протеогликаны: коллагеновые молекулы погружены в макромолекулярные агрегаты протеогликанов ― гигантских молекул, секретируемых хондроцитами. Главная функция протеогликанов ― связывание воды в хрящевом матриксе и обеспечение диффузии. Основа протеогликана ― гиалуроновая кислота. От неё в разные стороны отходят полипептидные цепи т.н. центрального белка. Длинные цепи центрального белка во множестве связывают боковые полисахаридные цепи (гликозаминогликаны). К глобулярному концу ц.б. присоединены короткие молекулы олигосахаридов, а к противоположному концу белка ― хондроитинсульфаты. По все длине молекулы ц.б. к нему прикреплены молекулы кератансульфата и олигосахаридов. По мере дифференцировки хондроцитов качественный состав гликозаминогликанов изменяется. Так, цепи хондроитинсульфата в молекуле протеогликана, синтезируемого молодыми хондроцитами, примерно в два раза длиннее, чем у зрелых клеток. Протеогликан молодых клеток содержит много хондроитин-6-сульфата. Включение х-6-с в ходе дифференцировки клеток уменьшается, но возрастает количество хондроитин-4-сульфата. Молодые клетки синтезируют короткие цепи кератансульфата, а старые клетки более длинные. Молекула протеогликана связывает (структурирует) большой объем воды. Количество структурированной воды определяет упругость х.т. при сжатии вода вытесняеися из областей вокруг сульфатированных и карбоксильных групп протеогликана, группы сближаются, и силы отталкивания между их отрицательными зарядами препятствует дальнейшему сжатию ткани. Вода возвращается на прежнее место при снятии давления. Т.о., если коллаген определяет прочность хряща, то протеогликан ― его упругость. Чем длиннее молекула хондроитинсульфата, тем больше воды структурируется. Поэтому протеогликан старых хондроцитов связывает меньше воды, вследствие чего хрящевой матрикс у пожилых людей становится менее упругим.
Хондронектин контролирует консистенцию матрикса, важен для развития хряща и поддержания его структуры. Молекула хондронектина имеет участки связывания коллагена типа II, протеогликанов и рецепторов хондронектина в плазмолемме хондроцитов. Т.о. функции хондронектина аналогичны фибронектину и ламинину. Хондронектин специфичен в отношении хондроцитов и коллаген типа II.
а) гиалиновый хрящ ― с возрастом обызвествляется;
б) эластический хрящ ― в х.м. присутствует сеть эластических волокон, менее подвержен дегенерации, содержит меньше липидов, гликогена, хондроитинсульфатов и не обызвествляется;
в) волокнистый хрящ испытывает большие механические нагрузки, как при сжатии, так и при растяжении. Коллагеновые волокна, формируя пучки, расположены параллельно друг другу.
4. Костная ткань. Костный матрикс ― 50% сухого веса кости и состоит из неорганических (50%) и органических (25%) частей и воды (25%). Неорганическая часть содержит Са (35%) и фосфор (25%), образующие кристаллы гидроксиапатита, а также входят в состав других неорганических веществ. Кристаллы гидроксиапатита соединяются с молекулой коллагена ч/з остеонектин. В состав неог. части кости также входят бикарбонаты, цитраты, фториды, соли Mg 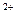 , K
, K 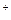 , Na
, Na 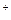 . Орг. часть ― коллагены (к. I типа 90-95%, к.V) и др. белки (остеонектин, остеокальцин, протеогликаны, сиалопротеины, мрфогенетические белки), а также гликозаминогликаны (хондроитинсульфат, кератансульфат). Орг. вещества костного матрикса синтезируют остеобласты. Остеонектин поддерживает в присутствии к. осаждение Са
. Орг. часть ― коллагены (к. I типа 90-95%, к.V) и др. белки (остеонектин, остеокальцин, протеогликаны, сиалопротеины, мрфогенетические белки), а также гликозаминогликаны (хондроитинсульфат, кератансульфат). Орг. вещества костного матрикса синтезируют остеобласты. Остеонектин поддерживает в присутствии к. осаждение Са 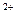 и РО
и РО 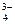 . Остеокальцин ― небольшой белок минеральном матриксе кости, участвует в процессе кальцификации.
. Остеокальцин ― небольшой белок минеральном матриксе кости, участвует в процессе кальцификации.
а) грубоволокнистая к.т. ― м/ж толстыми пучками беспорядочно расположенных коллагеновых волокон распол. удлиненные лакуны с длинными анастомозирующими канальцами. Характерно большое количество гликопротеинов и низким содержанием минеральных солей;
б) пластинчатая к.т. ― характерна костная пластинка, слой костного матрикса толщиной 3-7 мкм. М/ж соседними пластами в лакунах расп. остеоциты. Коллагеновые волокна в пределах пластинки ориентированны упорядоченно и лежат под углом к волокнам соседней пластинки, что обеспечивает прочность пластинчатой кости.
5. Кровь. М.в. ― плазма, 90% воды, 9% орг. веществ, 1% неорганических. Белков 6%.
6. Ткани со специальными свойствами:
а) Мезенхима ― гелеобразный внеклеточный матрикс, состоящий почти исключительно из основного вещества и минимальное количество рассеянных волокон (ретикулиновых).
б) Ретикулярная ткань ― рыхлая сеть ретикулиновых волокон является специфическим микроокружением для развития клеток крови. Синтезирует IL3, 7, GM-CSF, G-CSF, M-CSF.
в) Жировая ткань ― сеть ретикулиновых и коллагеновых волокон.
II. Эпителиальная ткань.
В эпителии практически нет м.в., клетки плотно примыкают одна к другой и связаны с помощью межклеточных контактов. Базальная мембрана ― толщина 20-100 нм, отделяет эпителий от подлежащей соединительной ткани, укрепляет эпителиальный пласт. Образуется за счет эпителия и подлежащей соединительной ткани. Содержит коллаген IV типа, ламинин, энтактин и протеогликаны. Эпителиальные клетки крепятся к б.м. с помощью полудесмосом






