Ag – мол-ла, способная вызывать им.ответ и реагировать с Ат или TCR.
Свойства антигенов:
1. Чужеродность (несет признаки генет. чужеродности) одно из основ. свойств любого Ag
2. Специфичность Ag обеспечивается наличием на поверхности актив. участков- эпитоп (контакт с Ат, у которого участок связывания наз- паратопом). На поверхности Ag есть доминантные, располож рядом друг с другом, эпитопные группы- Ag-ые детерминанты. Каждый Ag имеет несколько таких детерминант. Специф-ть детер-ты определяется хим. стр-рой группировки, положением и стереоизометрией
Виды специфичности: видовая –отличает один вид от другого; групповая –различия среди особей одного вида; гетероспец-ть - общие Ag для различных видов; функциональная спец-ть - действие сходных в Ag-ом отношение соединений, одинаковой функции у различных видов.
3. Иммуногенность (мера способности Ag вызывать и.о.): а)чем выше мол. масса тем более иммуногенен Ag. Пороговый вес 40000 Да. б)Разветвленность пространственной структуры. чем выше тем более иммуногенен Ag. в)Конформационная жесткость структуры. чем выше тем более иммуногенен Ag г)Чем лучше Ag ращепляется ферментами тем более иммуногенен Ag
4. Антигенность
Ag делят на тимусзависимые(в и.о. участвутвуют Тh) и тимуснезависимые (без)
Взаимодействие Ag-Ат: плотно прилегаю друг к другу за счет комплементарности, особенность комплекса- остаточная гибкость для макс-го контакта.
Силы связывания: электростатические, водородные, гидрофобные и Ван-дер-Ваальса
Аффинность- сродство связывающих участков и определяет силу связи (представляется константу ассоциации Ка).
Авидность- усредненная аффинность, величина оценивающая качественно-количественную сторону реакции между Ag-Ат, скорость соединения, полноту и прочность.
Aт - сывороточные или секреторные Ig обладающие, способностью к взаимодействию с Ag и гаптенами.
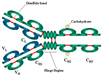 Мол-ла Ig – представляет собой гликопротеид с Mr=150кДа. Основная структура образована полипептидными цепями двух разных типов. Легкие, L цепи имеют Mr=25 кДа и одинаковы у всех классов, тогда как тяжелые, H цепи, Mr=50—77 кДа, структурно различны у разных классов и подклассов Ig. L цепи сущ-ют в 2 различных изотипических формах, обозначаемых как каппа (k) и лямбда (l). В молекуле Ig могут объединяться пары легких и тяжелых цепей любого типа, но обе цепи в паре относятся к одному типу. L и H цепи Ig-ов состоят из 2-х различных областей. С-концевая часть цепи константна у легких цепей всех типов, названа константной, или CL-областью. В то же время N-концевая часть цепи имеет множество вариантов аминокислотной последовательности, названа вариабельной, или VL-областью.И вариабельные, и константные области L и H цепей образуют стабилизированные внутрицепочечными и дисульфидными связями глобулярные структуры, называемые доменами. Легкая цепь состоит из одного вариабельного VL и одного константного, обозначаемого как СH, H цепь из одного вариабельного и также 3-4 константных СH1, СH2, СHЗ, СH4. Антигенсвязывающие центры молекулы Ig образованы вариабельными доменами VL и VH.. Отрезок H цепи между доменами СH1 и СH2 называют «шарнирной» областью; она обладает подвижностью, которая позволяет обоим антигенсвязывающим центрам функционировать независимо один от другого. За исключением домена СH2, домены одной тяжелой цепи тесно прилежат к гомологичным (V и С) доменам L цепи и к СHЗ-области другой H цепи. К СH2-доменам присоединяются углеводные компоненты. Каждый Ig-ый домен имеет третичную структуру и специфичную укладку цепи (фолдинг) и включает порядка110 а.к. остатков. Домен состоит из 2 слоев с b складчатой стр-рой, один слой построен из 4 антипараллельных сегментов цепи, другой- из 3 антипараллельных сегментов. Антитела по подклассу тяжелой цепи делятся на IgA, IgD, IgG, IgM, IgE. Основная, первичная функция антител — связывание с антигеном. Иногда, это непосредственно ведет к достижению эффекта, например, обеспечивая нейтрализацию бактериального токсина или предотвращая проникновение вируса в клетки.
Мол-ла Ig – представляет собой гликопротеид с Mr=150кДа. Основная структура образована полипептидными цепями двух разных типов. Легкие, L цепи имеют Mr=25 кДа и одинаковы у всех классов, тогда как тяжелые, H цепи, Mr=50—77 кДа, структурно различны у разных классов и подклассов Ig. L цепи сущ-ют в 2 различных изотипических формах, обозначаемых как каппа (k) и лямбда (l). В молекуле Ig могут объединяться пары легких и тяжелых цепей любого типа, но обе цепи в паре относятся к одному типу. L и H цепи Ig-ов состоят из 2-х различных областей. С-концевая часть цепи константна у легких цепей всех типов, названа константной, или CL-областью. В то же время N-концевая часть цепи имеет множество вариантов аминокислотной последовательности, названа вариабельной, или VL-областью.И вариабельные, и константные области L и H цепей образуют стабилизированные внутрицепочечными и дисульфидными связями глобулярные структуры, называемые доменами. Легкая цепь состоит из одного вариабельного VL и одного константного, обозначаемого как СH, H цепь из одного вариабельного и также 3-4 константных СH1, СH2, СHЗ, СH4. Антигенсвязывающие центры молекулы Ig образованы вариабельными доменами VL и VH.. Отрезок H цепи между доменами СH1 и СH2 называют «шарнирной» областью; она обладает подвижностью, которая позволяет обоим антигенсвязывающим центрам функционировать независимо один от другого. За исключением домена СH2, домены одной тяжелой цепи тесно прилежат к гомологичным (V и С) доменам L цепи и к СHЗ-области другой H цепи. К СH2-доменам присоединяются углеводные компоненты. Каждый Ig-ый домен имеет третичную структуру и специфичную укладку цепи (фолдинг) и включает порядка110 а.к. остатков. Домен состоит из 2 слоев с b складчатой стр-рой, один слой построен из 4 антипараллельных сегментов цепи, другой- из 3 антипараллельных сегментов. Антитела по подклассу тяжелой цепи делятся на IgA, IgD, IgG, IgM, IgE. Основная, первичная функция антител — связывание с антигеном. Иногда, это непосредственно ведет к достижению эффекта, например, обеспечивая нейтрализацию бактериального токсина или предотвращая проникновение вируса в клетки.
1 Свободные АТ, связываясь с микр-ми, обеспечивают их нейтрализацию. АТ, фиксированные на поверхностях клеток или их мембран, иммобилизируют патоген.
2 АТ, фиксированные на микробной клетке обуславливают связывание и активацию СК, что может обеспечить бактериолиз. В частности в молекуле IgG в домене СН2 находится участок ответственный за связывание компонента комплемента С4b и в домене СН3 – за связывание С1q.
3 АТ фиксированные на поверхности патогенов, распознаются Fc – рецепторами фагоцитирующих клеток (например нейтрофилы (Nf))=> фагоцитоз. Домен IgG СН2 + FcgRII, домены СН2 и СН3 + FcgRIII.
4 АТ, фиксирующиеся на FcgRI-рецепторах Mf, армируют их, => увел.
5 киллерную активность Mf в отношении опухолевых клеток (ОК) и обеспечивает специфичность их действия.
6 АТ, фиксированные на мембранных антигенах ОК, распознаются FcgRIII-рецепторами натуральных киллерных(NК)-клеток, что служит предпосылкой для осуществления направленного цитолиза.






