Свойства разбавленной и концентрированной серной кислоты;
Сернистая кислота, тиосерная кислота, тиосульфаты.
СЕРНАЯ КИСЛОТА H2SO4
Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r = 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду!
Химические свойства
H2SO4 - сильная двухосновная кислота
H2SO4 «H+ + HSO4- «2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+] • [SO42-]) / [HSO4-] = 1,2 • 10-2
I. Общие свойства кислот
1) с металлами левее водорода - выделяет водород:
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H2
2) с основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
3 ) с гидроксидами:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
4) обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4¯ + 2HCl
II. Cпецифические свойства -к онцентрированная H2+6SO4 – сильный окислитель;
1) с тяжелыми металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0
2Ag0 + 2H2+6SO4 конц → Ag2+1SO4 + S+4O2 + 2H2O
2) с активными металлами до H2S-2
8Na0 + 5H2+6SO4 конц → 4Na2+1SO4 + H2S-2 + 4H2O
(без нагревания не реагируют также Fe, Al, Cr - пассивируются):
3) при нагревании с некоторыми неметаллами:
С0 + 2H2S+6O4 (конц) → C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4 конц → 3S+4O2 + 2H2O
2P0 + 5H2S+6O4 конц → 5S+4O2 + 2H3P+5O4 + 2H2O
СЕРНИСТАЯ КИСЛОТА H2SO3
Сернистая кислота 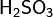 — неустойчивая слабая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4.
— неустойчивая слабая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4.
Физические свойства. Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Химические свойства
(двойственные свойства, т.к. промежуточная с.о.)
1. Диссоциирует, как кислота средней силы:
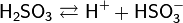

2. Со щелочами, как двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
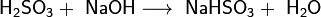
и средние — сульфиты (в избытке щёлочи):
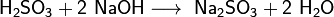
3.Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
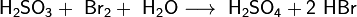
4.При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
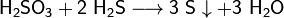
Применение
Сернистую кислоту и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей.
ТИОСЕРНАЯ КИСЛОТА H2SO3S или H2S2O3
Тиосерная кислота —двухосновная сильная кислота.
Бесцветная вязкая жидкость, реагирует с водой.
Образует соли — тиосульфаты.
Тиосерная кислота содержит два атома серы, один из которых имеет степень окисления +4, а второй — 0- электронейтрален. H2S+4O3S0
Термически неустойчива — разлагается уже при комнатной температуре.
Быстро, но не мгновенно, разлагается в водных растворах.
В присутствии серной кислоты разлагается мгновенно.
Химические свойства
1) Разлагается в присутствии серной кислоты
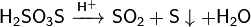
2) Со щелочами:
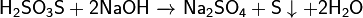
3) С галогенами:
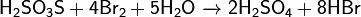
Качественные реакции






