Лабораторная работа № 1.
Общие закономерности химических реакций.
Цель работы: изучение влияния концентрации, температуры и катализатора на скорость реакций, а также влияния изменения температуры и концентрации реагирующих веществ на химическое равновесие.
Реактивы: тиосульфат натрия, серная кислота, дистиллированная вода, роданид железа, хлорид железа, роданид аммония.
Оборудование: колбочки, мензурка, секундомер, пробирки.
Теоретические основы (к первой части).
Скорость химической реакции - зависимость изменения концентрации одного из реагирующих веществ от времени.
Закон действия масс – скорость реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные соответствующим коэффициентам в уравнении реакции.
Правило Вант-Гоффа – при повышении температуры на каждые 10°C скорость химической реакции возрастает в 2-4 раза.
Катализатор – вещество, которое изменяет скорость химической реакции, причем его состав в конце процесса остается неизменным.
Катализ
 |  |
Гомогенный Гетерогенный
(катализатор и реагирующие (катализатор и реагирующие
вещества образуют однородную вещества находятся в разных
систему) фазах)
Катализ – явление изменения скорости химической реакции в присутствии веществ (катализаторов) состояние и количество которых после реакции не изменяется.
H < 0 – реакция экзотермическая, H > 0 - эндотермическая.
Опыт № 1. Влияние концентрации на скорость реакции.
Ход работы: В трех колбочках приготовили раствор тиосульфата натрия различной концентрации, методом варьирования количества и добавлением дистиллированной воды (3-я колбочка). После в каждую из колбочек добавили одинаковое количество серной кислоты. Растворы в пробирках помутнели в разные промежутки времени.
Уравнение реакции: Na2S2O3+ H2SO4 = Na2SO4 +H2O + SO2 + S↓
| Номер колбы | Объем, см3 | Относительная концентрация Na2S2O3 | Промежуток времени от начала отсчета до помутнения t, c | Относительная скорость реакции V= 1/t | ||
| Раствора Na2S2O3 | H2O | Раствора H2SO4 | ||||
| 0,05 | ||||||
| 0, 018 | ||||||
| 0, 005 |
 График.
График.
 V
V
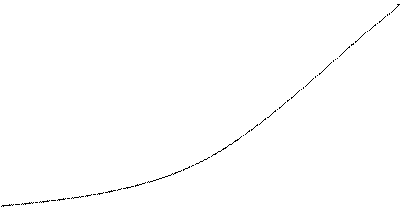 |
 0,05
0,05
0,018
0,005
C
Вывод: С увеличением концентрации возрастает скорость реакции.
Опыт № 2. Влияние температуры на скорость реакции.
Ход работы: Для данного опыта используются та же реакция, разве что концентрация во всех трех колбочках и тиосульфата и серной кислоты одинакова, различна лишь температура, при которой проходила каждая из реакций.
Уравнение реакции: Na2S2O3+ H2SO4 = Na2SO4 +H2O + SO2 + S↓
| Номер опыта | Температура опыта, °С | Промежуток времени от начала отсчета до помутнения t, c | Относительная скорость реакции V= 1/t |
| 0,01 | |||
| 0,02 | |||
| 0,03 |
Вывод: При повышении температуры на каждые 10 °С скорость реакции возрастает.






