Выполнил студ. Гр. Б01-721-1 Иванов Г.В
Проверил Кибенко В.Д.
Ижевск 2011
Цель работы:
1) Научиться определять характер среды в растворах различных солей.
2) Изучить влияние различных факторов на гидролиз.
3) Научиться оценивать степень гидролиза.
Теоретическая часть.
Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды.
Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием; в) слабым основанием и слабой кислотой;г)соль, образованная сильным основанием и сильной кислотой.
а) Гидролиз солей, образованных сильным основанием и слабой кислотой протекает всегда по аниону, заряд которого определяет число теоретических ступеней гидролиза. Реакция среды их водныз растворов - щелочная (рН > 7).
б) Гидролиз солей, образованных сильной кислотой и слабым основанием протекает всегда по катиону, заряд которого определяет число теоретических ступений гидролиза. Реакция среды их водных растворов кислая (рН < 7).
в) Гидролиз солей, образованных слабым основанием и слабой кислотой протекает одновременно по катиону и по аниону, образуя сразу два слабых электролита. Реакция среды водного раствора такой соли устанавливается путем сравнения констант диссоциации образующихся слабых электролитов. Если константы диссоциации основания и кислоты близки, то реакция раствора остается практически нейтральной, если же они различаются на несколько порядков, то среда может быть слабокислой или слабощелочной - в зависимости от силы кислоты и основания.
г) Соль, образованная сильным основанием и сильной кислотой. Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами H+ и OH-воды слабодиссоциируюших или труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН равен 7.
Полный и необратимый гидролиз солей. Некоторые соли, образованные слабыми летучими кислотами и многокислотными гидроксидами не могут находиться в виде водных растворов из-за полного необратимого взаимодействия с водой, сопровождающегося одновременным выделением газа и выпадением осадка.
При взаимодействии сульфида алюминия с водой наблюдается образование осадка гидроксида алюминия и выделение сероводорода
Al2S3 + 6H2O = 2Al(OH)3↓ + H2S↑
Количественно гидролиз характеризуется безразмерной величиной 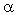 г, называемой степенью гидролиза и показывающей, какая часть от общего количества молекул соли, находящихся в растворе, подвергается гидролизу:
г, называемой степенью гидролиза и показывающей, какая часть от общего количества молекул соли, находящихся в растворе, подвергается гидролизу: 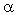 г = n / N •100%, где n – число гидролизованных молекул, N – общее число молекул в данном растворе.
г = n / N •100%, где n – число гидролизованных молекул, N – общее число молекул в данном растворе.
Константа гидролиза — константа равновесия гидролитической реакции.
К=[продуктов р-ии]/[исходных в-в].
Экспериментальная часть.
Опыт 1.
Реакции среды в различных растворах солей.
В четыре пробирки до 1/3 их объема налили растворы следующих солей: в первую - NaCH3COO, во вторую - AlCl3, в третью - Na2CO3, в четвертую - KCl.
С помощью лакмуса и универсального индикатора определи характер среды растворов солей. Полученные данные представлены в таблице.
Таблица экспериментальных и расчетных данных.
| № | Формула соли | Окраска лакмуса | рН по унив. индикатору | Характер среды |
| NaCH3COO | синий | Слабощелочная | ||
| AlCl3 | красный | Кислая | ||
| Na2CO3 | синий | Сильнощелочная | ||
| KCl | синий | Нейтральная |
1)NaCH3COO + HOH = NaOН + CH3COOH
Na+ + CH3COO- + HOH = Na+ + OH- + CH3COOH
CH3COO- + HOH = OН- + CH3COOH
рН>7
2) AlCl3 + HOH = AlOHCl2 + HCl
Al3+ + 3Cl- + HOH = AlOH2+ + 2Cl- + H+ + Cl-
Al3+ + HOH = AlOH2+ + H+
рН<7
3) Первая ступень:
Na2CO3 + НОН = NaНCO3 + NaOH
2Na+ + CO32- + HOH = Na+ + НCO3- + Na+ + OH
CO32- + НОН = НCO3- + OH-
Вторая ступень:
NaНCO3+ HOH= NaOH+ Н2 CO3
Na++ НCO3 + HOH== Na+ + OH- + Н2 CO3-
НCO3 + HOH= OH- + Н2 CO3-
рН>7
4) KCl гидролизу не подвергается. рН=7
Вывод: Характер среды раствора соли зависит от того из чего образованна соль.
Опыт 2.
Случаи полного (необратимого гидролиза)
В две пробирки добавили раствор AlCl3. В одну из них добавили (NH4)2S, в другую - Na2CO3.Наблюдали образование белого студенистого осадка в обеих пробирках и выделение пузырьков газа: в первой пробирке с неприятным запахом (H2S), во второй пробирке пузырьки газа без запаха (CO2).
1) AlCl3 + (NH4)2S+ НОН=Al(OH)3 + H2S +
2) 2AlCl3 + 3Na2CO3+ 3НОН= 2Al(OH)3+ 3CO2+6NaCl
2Al3+ + 6Cl- +6Na+ + 3CO32- + 3НОН=2Al(OH)3+ 3CO2 +6Na++6Cl-
2Al3+ + 3CO32- + 3НОН=2Al(OH)3+ 3CO2
Вывод: Соли, образованные слабыми летучими кислотами и многокислотными гидроксидами не могут находиться в виде водных растворов из-за полного необратимого взаимодействия с водой, сопровождающегося одновременным выделением газа и выпадением осадка.
Опыт 3.






