Первый закон термодинамики – это количественное выражение закона сохранения и превращения энергии применительно к задачам технической термодинамики. Он устанавливает взаимосвязь между теплотой Q, работой 1 и изменением энергии Е термодинамической системы.
При любом термодинамическом процессе обмен энергией системы с окружающей средой происходит в форме теплоты или механической работы. В первом случае обмен осуществляется при контакте тел с различной температурой. Энергия передается на молекулярном уровне от более нагретого тела к холодному. Количество подведенной или отведенной теплоты обозначают буквой Q, Дж.
Если теплоту относят к 1 кг массы М, то ее количество обозначают через q, Дж/кг и называют удельной теплотой:
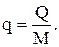
Второй способ передачи энергии происходит при изменении объема тела V. Количество переданной энергии соответствует работе расширения, совершенной над телом или затраченной им. Величину работы расширения обозначают буквой L, Дж, а отнесенное к единице массы ее количество l, Дж/кг - удельной работой.
Работа расширения газа в процессе определяется по формуле
 (1.2)
(1.2)
или
 (1.3)
(1.3)
Из (1.2) следует, что:
▪ если dV > 0, то L > 0, т. е. при расширении работа тела положительна, при этом тело само совершает работу;
▪ если dV < 0, то L < 0, т. е. при сжатии работа отрицательна, другими словами, на его сжатие затрачивается работа извне.
Любая термодинамическая система обладает запасом энергии, которую называют внутренней энергией системы U. Под внутренней энергией U понимают кинетическую энергию хаотического движения молекул и атомов, а также потенциальную энергию сил взаимодействия между молекулами.
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических системах. В свою очередь, изменение внутренней энергии определяется только начальным и конечным состояниями системы:
ΔU = U2 – U1, Дж. (1.4)
Изменение энергии для 1 кг вещества:
Δu = u2 – u1, Дж/кг. (1.5)
При одновременном тепловом и механическом взаимодействиях системы со средой изменение внутренней энергии будет зависеть как от количества подведенной (отведенной) теплоты, так и от произведенной системой работы, т. е.
u2 – u1 = q – l (1.6)
или
q = l + Δu. (1.7)
Уравнения (1.6) и (1.7) называют уравнениями первого закона термодинамики. Согласно этим уравнениям первый закон термодинамики можно сформулировать следующим образом: теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
В дифференциальной форме уравнение первого закона термодинамики имеет вид
dq = du + dl = du + Pdν. (1.8)
Выражение (1.8) можно записать в другой форме, если ввести функцию u + pν, называемую энтальпией системы h, Дж/кг. Энтальпия, составленная из параметров состояния, также является параметром состояния, имеет полный дифференциал dh:
dh = du + pdν + νdp, (1.9)
du +pdν = dh – νdp. (1.10)
Подставляя (1.10) в соотношение (1.8), получаем выражение первого закона через энтальпию h:
dq = dh – νdp. (1.11)
Для основных термодинамических процессов из соотношения (1.8) можно получить частные случаи первого закона.
При q = 0 (адиабатный процесс)
dl = -du или –dl = du; (1.12)
du = 0 (изохорный процесс)
dq = du (1.13)
dp = 0 (изобарный процесс)
dq = du + dl; (1.14)
dT = 0 (изотермический процесс)
dq = dl.






