Энтропию называют «тенью» внутренней энергии и она, также как U, является функцией состояния. Таким образом, dS – полный дифференциал энтропии.
Энтропию, как функцию состояния, для термодеформационной системы можно выразить через любое из трех сочетаний термодинамических параметров T, V, P: S=S(T, V), S=S(T,P) и S=S(P,V) и получить три группы равнозначных формул.
· Получим первую группу формул для расчета энтропии.
Пусть S = S(T,V),

Как было получено ранее (88)
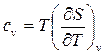 тогда
тогда

Здесь  - третий тип дифференциальных соотношений термодинамики
- третий тип дифференциальных соотношений термодинамики
 , тогда окончательно
, тогда окончательно
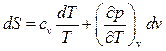 (104)
(104)
Формула (104) применима как для реальных, так и для и идеальных газов.
Для идеального газа эта формула имеет более простой вид. Получим эту формулу. Для идеального газа известно (77):

Подставим (77) в (104) и окончательно получим:
 (105)
(105)
Формула (105) применима только для идеального газа.
Найдем неопределенный интеграл S из (105)
 .
.
Полагаем 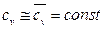
Здесь  - средняя массовая изохорная теплоёмкость
- средняя массовая изохорная теплоёмкость
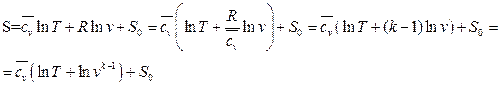
или
 (106)
(106)
Здесь, 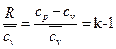
где 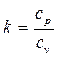 - показатель адиабаты.
- показатель адиабаты.
Попутно рассмотрим адиабатный обратимый процесс, то есть процесс при S=const
Так как в (106) S0 и  константы, то для выполнения условия S=const должно выполняться условие
константы, то для выполнения условия S=const должно выполняться условие

Это уравнение называется уравнением адиабаты идеального газа или уравнением Пуассона.
Для практики наибольший интерес представляет не абсолютное значение S, а её изменение dS.
Найдем определенный интеграл энтропии по формуле (105):

Пусть  тогда
тогда
 (107)
(107)
Из (107) можно получить два частных случая:

 (108)
(108)

 (109)
(109)
Здесь S имеет размерность 
Энтропия – это мера неупорядоченности системы (чем больше энтропия, тем больше беспорядок).
При S = 0 должно отсутствовать не только макроскопическое, но и микроскопическое движение частиц, поэтому энтропия может быть равна нулю только при абсолютном нуле температур.
Но по 3-ему закону термодинамики (следствию тепловой теоремы Нернста) при T®0, S®0 абсолютный нуль температур недостижим.
В инженерной практике, начало отсчета энтропии может быть выбрано произвольно. Условились, за начало отсчёта энтропии принимать нормальные физические условия (н.ф.у.): pн=101325 Па, Tн=273.15 K. Таким образом, при н.ф.у S=0.
При этом уравнение (107) примет вид

Индекс 2 опускаем, тогда окончательно энтропию можно вычислить по следующей формуле
 (110)
(110)
Здесь vн – удельный объём при нормальных физических условиях.
Из pнvн=RTн,

Здесь µ - молекулярная масса газа.
Как известно, по закону Авогадро 1 Кмоль любого газа при одинаковых условиях занимает один и тот же объём, в частности при нормальных физических условиях 1 Кмоль любого газа занимает объём, равный 22,4 м3.
Во всех вышеприведённых формулах массовая изохорная теплоёмкость cv бралась средним значением  .
.
Получим формулы для случая линейной зависимости теплоёмкости от температуры cv=c0v+aT
Подставим это в (105)

Окончательно
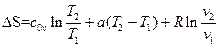 (111)
(111)
Из (111) следуют два частных случая (Т=const и V=const)
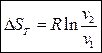 (формула (108))
(формула (108))
 (112)
(112)
Принимая S=0 при нормальных физических условиях, получим формулы для расчёта энтропии:
 (113)
(113)
· Получим вторую группу формул для расчёта энтропии.
Пусть S=S(T,P)

 (114)
(114)
Формула (114) справедлива для любого газа и любого процесса
В качестве частного случая рассмотрим идеальный газ:
Для идеального газа из (78)

Подставим (78) в (114)
 (115)
(115)
Найдем неопределенный интеграл S по формуле (115)
 (116)
(116)
где S0 – константа интегрирования
Пусть  , тогда
, тогда
 ,
,
Выразим отношение  через теплоемкости
через теплоемкости

Тогда
 (117)
(117)
Попутно рассмотрим адиабатный процесс, полагая его обратимым. Тогда уравнение адиабатного процесса запишется в виде S=const
 Так как в уравнение (117) при условии S=const правая часть также должна быть константой, то при ср=const и S0=const должно выполняться условие
Так как в уравнение (117) при условии S=const правая часть также должна быть константой, то при ср=const и S0=const должно выполняться условие
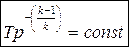 (118)
(118)
Уравнение (118) называется уравнением адиабаты идеального газа или уравнением Пуассона.
Вернемся к (115) и найдем определенный интеграл энтропии:
 (119)
(119)
Эта формула применима для любого процесса идеального газа.
Из (119) следуют два частных случая:
 (120)
(120)
 (121)
(121)
Если взять за начало отсчёта S нормальные физические условия, то из (119) получим зависимость для расчета энтропии:
 (122)
(122)
Получим формулы второй группы для случая, когда изобарная теплоемкость линейно-зависит от температуры (ср=с0р+аТ). Подставим ср в (115) и найдем определенный интеграл:
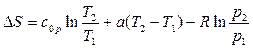 (123)
(123)
Эта формула применима для любого процесса идеального газа.
Из (123) следует два частных случая:
 (формула (120))
(формула (120))
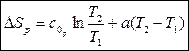 (124)
(124)
Полагая за начало отчета S н.ф.у получим формулу для расчета энтропии идеального газа в любом процессе
 (125)
(125)
· Получим третью группу формул:
Пусть S = S(p,v),

Здесь частные производные заменены произведением частных производных.

 (126)
(126)
Формула (126) справедлива для всех процессов как реального так и для идеального газов.
В качестве частного случая рассмотрим идеальный газ:
Как известно, для идеального газа
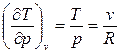 ,
,
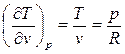 ,
,
Подставим эти значения частных производных в (126) и получим формулу, справедливую для всех процессов идеального газа:
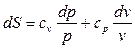 (127)
(127)
Попутно рассмотрим обратимый адиабатный процесс (S=const) и найдем определенный интеграл (127):
 .
.
Полагаем 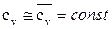 и
и 
Тогда

В адиабатном процессе S=const и правая часть этого уравнения также является константой, если
 (128)
(128)
Уравнение (128) называется уравнением адиабаты идеального газа или уравнением Пуассона.
Окончательно, адиабатные процессы идеального газа описываются тремя равнозначными уравнениями Пуассона.
 ;
;
 ; (129)
; (129)
 .
.
Вернемся к формуле (115) и возьмём определённый интеграл энтропии:
 (130)
(130)
Из (130) следуют два частных случая:
 (формула (121))
(формула (121))
 (формула (109))
(формула (109))
Принимая за начало отсчёта S нормальные физические условия, из (130) получим формулу:
 (131)
(131)
где  - удельный объем идеального газа при н.ф.у.
- удельный объем идеального газа при н.ф.у.
Получим формулы для случая линейной зависимости теплоёмкостей от температуры:
cv=c0v+aT и cp=c0p+aT, где c0v, c0p, а – постоянные величины.

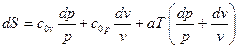 (132)
(132)
Найдём значение  из уравнения Менделеева-Клапейрона после его логарифмирования и дифференцирования:
из уравнения Менделеева-Клапейрона после его логарифмирования и дифференцирования:

Подставим это выражение в (132)
 (133)
(133)
Интегрируя (133) получим:
 (134)
(134)
Из (134) следует три частных случая:
 (135)
(135)
 (136)
(136)

Преобразуем эту формулу:

или
 (формула (120))
(формула (120))
Полагая S=0 при нормальных физических условиях, из (134) получим формулу для расчета значения энтропии идеального газа в любом процессе
 (137)
(137)






